Evaluation du risque hémorragique au cours de la leucémie aigue promyélocytaire
Y.L. DIALLO1, B. GUILLET2, M. DOUMBERE1, B.S. TRAORE1, T. LAMY3
1 : Service de médecine hôpital du Mali, Bamako Mali, 2 : Centre régional de traitement de l’hémophilie CHU de Pontchaillou Rennes, France, 3 : Service d’hématologie clinique CHU de Pontchaillou Rennes, France.
L’hémorragie reste une cause majeure de mortalité de leucémie aigue promyélocytaire (LAP). Dans les pays à ressources limitées la réduction de la survenue des évènements hémorragiques pourrait améliorer le pronostic vital de cette maladie. L’objectif de ce travail est d’identifier des marqueurs simples permettant d’identifier et de prévenir la survenue d’un évènement hémorragique chez ces malades.
Il s’agissait d’une étude prospective mono centrique conduite dans le service d’hématologie clinique du CHU de Pontchaillou. Elle a porté sur 19 dossiers de LAP traités selon les protocoles APL 2000 ou 2006, de janvier 2003 à Avril 2009. Les données cliniques, biologiques, immuno-histochimiques et cytogénétiques, collectées à partir des registres et des dossiers d’hospitalisation ont été saisies et analysées sur SPSS 17.0. Le test de Khi2 et les tests non paramétriques, ont été utilisés pour l’analyse comparative des variables avec un p < 0.05 considéré comme significatif.
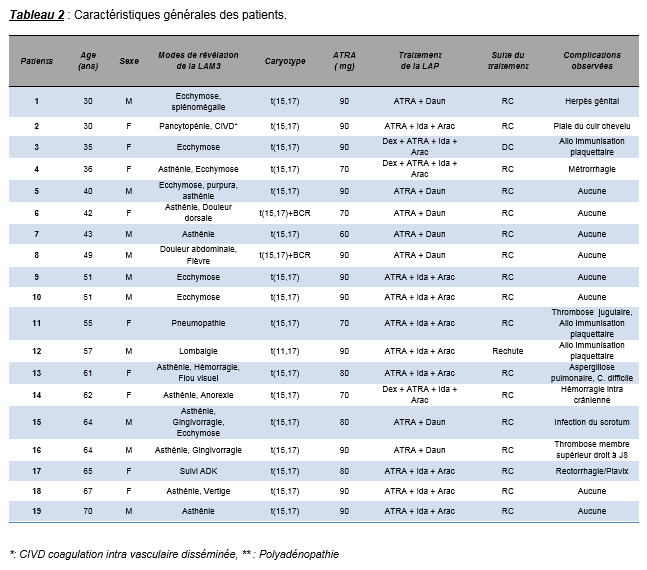
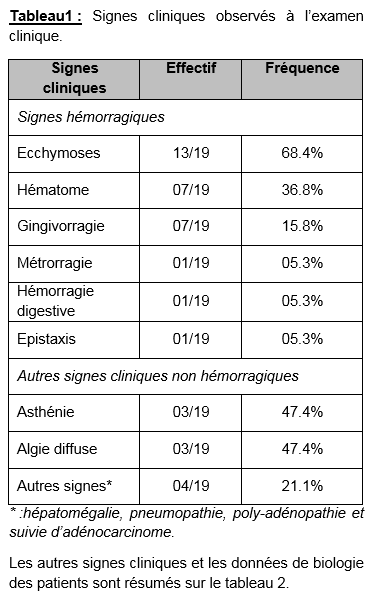
Le sexe ratio homme- femme était de 1.11. L’âge moyen était de 50 ans (extrêmes : 30 et 70 ans). La t(15,17) était retrouvée chez 18 patients dont 2 associées au transcris BCR, et une à t(11,17). Les signes hémorragiques à type d’ecchymose, d’épistaxis ou de d’hémorragie massive ont été retrouvés chez 16 patients. Au diagnostic le taux d’hémoglobine moyen était de 9.1 g/dL (extrêmes : 4.8 et 12.8 g/dL), les leucocytes à 9.1 G/L (extrêmes : 0.5 et 66.8 G/L) avec une blastose moyenne de 27.9% (extrêmes : 0 et 98%). La thrombopénie était constante avec un nombre moyen de plaquettes de 49.9 G/L (extrêmes : 6 et 102 G/L). Trois patients ont présenté des complications hémorragiques. Nous n’avons trouvé aucune corrélation entre les différents paramètres étudiés et la survenue d’une complication hémorragique.
Conclusion :
Au cours de la LAP, l’hémostase primaire semble plus affecter que la coagulation. Nous n’avons trouvé aucune corrélation statistiquement significative entre les paramètres étudiés et la survenue d’une complication hémorragique, mais cela devrait se confirmer sur une large cohorte.
Haemorrhage remains a major cause of death during acute promyelocytic leukemia (APL). Reducing the frequency of hemorrhagic events in resource-limited could improve the prognosis of this disease. The objective of this study is to identify and prevent hemorrhagic event in these patients.
This was a prospective, mono-centric study conducted in the department of clinical hematology at the CHU de Pontchaillou. From January 2003 to April 2009, we have included 19 LAP cases treated according to the APL 2000 or 2006 protocols. Clinical, biological, immunohistochemical and cytogenetic data collected from the hospital records and files were entered and analyzed by SPSS 17.0. The chi-square test and the non-parametric tests were used for the comparative analysis of the variables with p<0.05 considered significant.
The gender ratio was 1.11. The mean age was 50 years (range: 30 and 70 years). The t(15,17) was found in 18 patients, 2 of whom were associated to the BCR transcript, and one with t(11,17). Bleeding signs such as bruising, epistaxis or massive haemorrhage were found in 16 patients. The mean hemoglobin was 9.1 g / dL (range: 4.8 and 12.8 g / dL), leukocytes at 9.1 G / L (range: 0.5 and 66.8 G / L) with an means blastosis of 27.9% (range: 0 and 98%). Thrombocytopenia was constant with an mean platelet count of 49.9 G / L (range: 6 and 102 G / L). Three patients presented with haemorrhagic complications. We found no correlation between the different parameters studied and the occurrence of a hemorrhagic complication.
Conclusion:
In the LAP, primary hemostasis seems to affect more than coagulation. We found no statistically significant correlation between the parameters studied and the occurrence of a hemorrhagic complication, but this should be confirmed on a large cohort.
Dr Yacouba Lazare DIALLO, chargé de recherche en hématologie, service de médecine hôpital du Mali, 03 BP 106 Bamako, Mali, Email : Cette adresse e-mail est protégée contre les robots spammeurs. Vous devez activer le JavaScript pour la visualiser. . Tél : 00223 69 29 30 15.
Introduction
La leucémie promyélocytaire (LAP) est une entité clinique, biologique, cytogénétique et thérapeutique de leucémie aigue myéloblastique [1]. Elle représente 8 à 15% des leucémies aigues non lymphoblastiques [2]. L’incidence annuelle qui augmente avec l’âge jusqu’à 60 ans, est estimée à 2 - 3 nouveaux cas par million d’habitant [3]. Sur le plan physiopathologique, la LAP se caractérise par un blocage de maturation myéloïde au stade de promyélocytes[1]. Elle est associée à la présence d’une translocation t(15,17)(q22,q21) aboutissant à la formation d’une protéine de fusion des gènes Promyelocyt Leukemia (PML) et le récepteur alpha de l’acide rétinoïque (RARα) [4]. De par la richesse des promyélocytes en facteur tissulaire, cette entité de leucémie se caractérise sur le plan clinique par la fréquence des troubles de l’hémostase [1, 5]. Ces troubles sont souvent un mode de révélation de la maladie [6]. Ils peuvent être hémorragiques ou thrombotiques. Les évènements hémorragiques rapportés dans 90% des cas, peuvent intéresser tous les organes [7]. Dans une étude rétrospective, Stein E et al sur une série de 34 cas de LAP, ont rapporté une hémorragie du système nerveux dans 65 à 80% des malades et 12% de thromboses sévères [6].
Le pronostic de cette maladie s’est considérablement amélioré depuis l’association de l’acide rétinoïque et de l’arsenic à la chimiothérapie conventionnelle [4, 8, 9]. En dépit de ces progrès, la mortalité diversement appréciée par les auteurs reste élevée [5, 9, 10]. En 1997, Tallman MS et al ont rapporté sur une population de 346 patients, 43 décès dont la première cause était l’hémorragie [11]. En 2007 au Brésil, sur une population de 134 cas de LAP, les auteurs ont rapporté 32% de décès précoces dont 66% dues à une hémorragie [10]. Les troubles de l’hémostase restent une question importante non encore résolue dans la prise en charge de la LAP [5]. Ceci incite à la recherche et au traitement d’une coagulopathie de consommation dans le schéma de prise en charge de la LAP [5]. L’objectif est de maintenir un taux de fibrinogène entre 1 et 1.5g/dL et les plaquettes au-delà de 30 à 50.109/l [5]. Dans ce travail nous faisons une analyse prospective des troubles de l’hémostase survenant chez les patients traités pour LAP. L’objectif principal est de contribuer à réduire le taux de mortalité par hémorragie.
Patients et Méthode :
Il s’agissait d’une étude prospective descriptive mono centrique de dossiers de malades traité pour une LAP. L’étude a été conduite dans le service d’hématologie clinique au CHU de Rennes entre le 1er janvier 2003 et le 30 Avril 2009. Tous les patients sans distinction de sexe, race ou âge traités pour une LAP ont été retenus. Les critères des protocoles APL 2000 ou 2006 ont été utilisés pour l’évaluation du risque pronostic, thérapeutique et évolutif.
Les données cliniques, biologiques et thérapeutiques et évolutives de J1 à J15 du traitement, ont été glanées à partir du registre des hémopathies du service et les dossiers d’hospitalisation des malades. La recherche de stigmate de trouble de l’hémostase, a été faite sur la base des données cliniques et biologiques. Il s’agissait de l’hémogramme, des données de l’hémostase : le taux de prothrombine (TP), le temps de céphaline en présence d’activateur (TCA), le fibrinogène, les D-Dimères, les concentrations plasmatiques des protéines de l’hémostase (II, V, VII et X).
Sur le plan thérapeutique et évolutif, nous avons étudié les doses d’ATRA et de chimiothérapie utilisées ainsi que les complications observées.
Les données ont été saisies et analysées sur SPSS 17.0. Le test de Khi2 et les tests non paramétriques, ont été utilisés pour l’analyse comparative des variables avec un p < 0.05 considéré comme significatif.
Résultats:
De janvier 2003 à Avril 2009, 21 cas de LAP ont été pris en charge dans le service d’hématologie du CHU de Pontchaillou soit une moyenne de 3 cas par an. Nous avons retenu 19 dossiers jugés complet pour l’étude. Deux dossiers n’ont pas été retenus parce que le dossier initial n’a pas été retrouvé dans un cas et l’autre patient a été transféré dans un autre centre pour son suivi.
Le sexe ratio homme- femme était de 1.11. L’âge moyen était de 50 ans (extrêmes : 30 et 70 ans). Les patients de plus de 51 ans représentaient 58% de la cohorte étudiée.
Les signes cliniques retrouvés à l’examen clinique sont dominés par les ecchymoses, les hématomes et les gingivorragies (tableau 1).
Données biologiques :
Sur le bilan initial, le taux d’hémoglobine moyen était de 9.1 g/dL (extrêmes 4.8 – 12.8 g/dL). Le nombre moyen de leucocytes étaient de 9.1 G/L (extrêmes 0.5 – 66.8 G/L) avec une moyenne de 27.9% (extrêmes : 0 - 98%) de blastes circulants. La blastose était retrouvée chez 74% des patients. Trente-deux pour cent (6/19) des patients avaient une leucopénie inférieure à 1 G/L. Le nombre moyen de plaquettes était de 46.9 G/L (entre 6 et 102 G/L). Dans le contexte de coagulopathie associée à la LAP, 13 patients (68%) présentaient un risque hémorragique avec moins de 50 G/L.
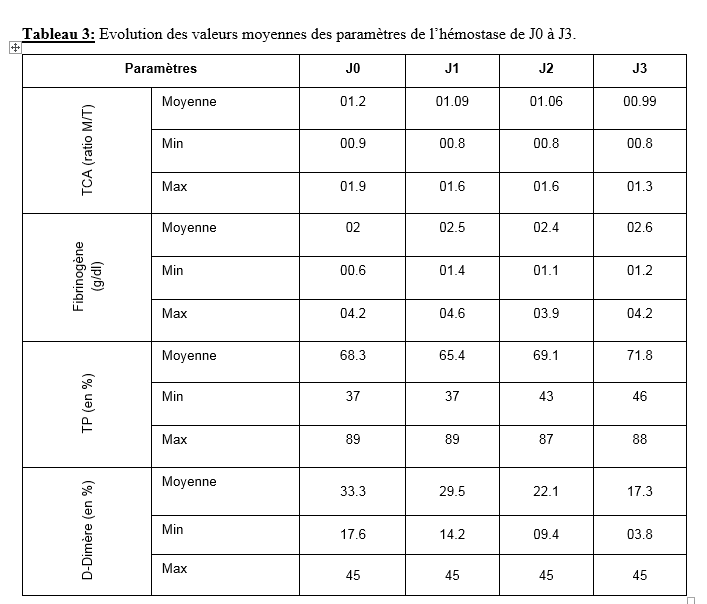
Le résultat du myélogramme a été retrouvé chez 18 patients. Le taux moyen de blastes était de 75.4% compris entre 38 et 95% des éléments nucléés. L’expression de la myeloperoxydase (MPO) était constante chez tous les malades. Outre la MPO, les blastes exprimaient dans 94.7% des cas le CD33, dans 88.9% des cas les marqueurs myéloïdes CD13 et dans 73.7% des cas le CD117. En cytogénétique, nous avons observé la présence de la t(15,17) chez 18 patients (94.7%). Elle était associée au transcrit BCR chez 2 malades. Une fois la t(11,17) a été observée. Nous avons étudié les paramètres biologiques de l’hémostase de J1 à J15 de l’induction. Malheureusement ce bilan n’était pas disponible à partir de J3. Le tableau 3 montre l’évolution de la moyenne des paramètres de l’hémostase de J1 à J3.
Le dosage des D-Dimères a été réalisé chez 17 patients et la recherche des complexes solubles chez 12 patients. Tous les patients avaient des D-Dimères élevés (100%), le taux le plus bas était 15µg/mL, 9 patients sur 10 avaient des valeurs supérieures à 45µg/ml (N : < 0.5µg/mL). Les complexes solubles étaient positifs chez 4 patients, faiblement positifs dans 3 cas et négatifs dans 5 autres cas. Ils n’ont pas été recherchés chez 7 malades.
Aspects thérapeutiques et évolutifs:
Les patients ont été traités selon les protocoles APL 2000 ou 2006 de prise en charge de la LAP. Dans ces protocoles l’ATRA donné à 45 mg/m² est associé à une chimiothérapie d’induction des leucémies aigues myéloblastiques. La dose totale moyenne d’ATRA était de 82.6 mg avec des extrêmes entre 60 mg et 90 mg. Le délai moyen entre la mise sous ATRA et le début de l’induction était de 2.7 jours avec des extrêmes entre 0 et 6 jours. Les combinaisons suivantes ont été utilisées pour la prise en charge des patients.
- ATRA + Daunorubicine : 7 patients
- ATRA + Daunorubicine + Aracytine : 12 patients.
La Dexamétasone a été associée dans 3 cas en prévention d’un éventuel ATRA syndrome.
La rémission complète à la première induction a été obtenue chez tous les patients (100%). Une rechute et un décès par choc septique ont été constatés.
Complications observées :
Nous avons observé chez 11 malades des complications. Il s’agissait essentiellement dans 7cas de complications associés à un trouble de l’hémostase et 4 cas d’infection. Sur les complications associés à un trouble de l’hémostase, il y’avait 3 associées à une hémorragie ; 2 cas de thromboses veineuses et 2 cas d’allo-immunisation plaquettaire. En nous intéressant aux cas d’hémorragie observés, il s’agissait d’hémorragie intracrânienne, une métrorragie et une rectorragie. La rectorragie a été observée chez un patient était sous plavix dans son traitement. Ces hémorragies sont assimilables à un trouble de l’hémostase primaire.
Discussion :
L’objectif de notre étude était d’étudier les marqueurs cliniques et biologiques associés aux complications hémorragiques chez les patients traités pour une LAP.
Sur une période 6 ans et 4 mois, 21 LAP ont été prises en charge dans le service d’hématologie clinique du CHU de Pontchaillou, soit une moyenne de 3 cas/an. Nous avons analysé 19 dossiers. La moyenne d’âge était de 55 ans. Plus de la moitié des patients (58%) avaient moins de 51 ans. Le sexe masculin était dominant 58% des cas. Nos résultats corroborent les données de la littérature. En effet l’incidence annuelle rapportée dans la littérature est de 2 à 3 cas/an [16]. La LAP est rare avant 10 ans et après 60 ans [16].
Au cours de cette étude, 11 patients ont présentés des complications. Il s’agissait essentiellement de 4 cas d’infection, 3cas d’hémorragie et 2 cas de thromboses et 2 cas d’allo-immunisation plaquettaire. Ces syndromes hémorragiques observés sont le plus souvent associés à une anomalie de l’hémostase primaire ou de la fibrinoformation. Ceci nous laisse supposer que l’hémostase primaire ou la fibrinoformation sont plus affectées que la coagulation. Cette hypothèse pourrait être confortée par les thrombopénies fréquentes au diagnostic. Mais dans la population de patients ayant présentés des syndromes hémorragiques, le taux moyen de plaquettes était plus élevé (52 G/L) que dans la population témoin (47 G/L). Les plaquettes constituent un acteur majeur de l’hémostase primaire [12, 13].
Contrairement aux données de la littérature estimant un risque hémorragique moindre au-delà de 50 G/L, notre population témoins avait un taux moyen de plaquettes à 47 G/L [4, 11]. Le taux de plaquettes n’apparait pas comme un facteur prédictif de risque hémorragique dans la cohorte.
Mais nos résultats doivent être interprétés avec attention car notre étude présente quelques écueils qui doivent être pris en compte.
La taille limite de la population étudiée ne permet pas d’être univoque sur nos conclusions. Cependant nous avons un aperçu qui conforte les données de la littérature sur la fréquence des complications hémorragiques au cours de la LAP [14, 15]. L’absence de critères préalablement définis pour le suivi clinique des patients et les variations dans la gestion quotidienne des dossiers des patients nous a conduits à focaliser notre analyse sur les données biologiques notamment le bilan d’hémostase puisque tous les examens sont effectués dans le même laboratoire. Nous avons fait la moyenne des valeurs des différents paramètres obtenus chez chaque patient dans la cohorte.
A la recherche d’un facteur prédictif du risque hémorragique, nous avons répartis nos patients en deux groupes (ceux qui ont fait des complications hémorragiques et ceux qui n’ont pas saignés). Cette répartition a été inégale du fait de la taille des deux populations de la cohorte (3 contre 16). Aussi du fait de l’absence d’un rythme de suivi préalablement établi, le bilan n’était pas fait quotidiennement chez tous les patients. Les valeurs moyennes obtenues dans les deux groupes peuvent donc ne pas refléter la réalité. Suite à cette contrainte notre objectif d’analyse des paramètres cliniques et biologiques s’est limité à J3 contre J15 initialement prévue. L’évolution des paramètres de J0 à J3 est assez encourageante et incite à poursuivre les investigations à la recherche d’une corrélation entre les évènements hémorragiques et l’évolution des données de biologie.
Les autres paramètres de l’hémostase primaire (hémoglobine et fibrinogène) ne permettent pas d’expliquer cette symptomatologie, puisqu’il n’y avait de différence entre les deux groupes au diagnostic (9.1 g/dL).
Une hypothèse peut être la forte prédominance de blastes associé à un faible taux des D-Dimère au diagnostic. En effet le taux de blastes était plus élevé dans la population d’étude. Les auteurs s’accordent sur la richesse des promyélocytes en activateur de la coagulation (facteur tissulaire, annexine II et urokinase) [6, 7, 17, 18]. La différenciation induite par l’ATRA expose t’elle les patients fortement blastiques au diagnostic à un risque hémorragique ? Mais la symptomatologie clinique observée dans la cohorte ne plaide pas en faveur d’une hyper activation de la coagulation.
Conclusion
L’objectif principal de cette étude est de contribuer à améliorer la prise en charge des malades atteints de LAP. Les résultats obtenus quoique discutables encouragent à poursuivre ces investigations sur une large cohorte de patients afin d’identifier les marqueurs permettant d’identifier un sujet à risque de complications hémorragiques.
1. Avvisati, G., F. Lo Coco, and F. Mandelli, Acute promyelocytic leukemia: clinical and morphologic features and prognostic factors. Seminars in hematology, 2001. 38(1): p. 4-12.
2. Douer, D., et al., High frequency of acute promyelocytic leukemia among Latinos with acute myeloid leukemia. Blood, 1996. 87(1): p. 308-13.
3. Vickers, M., G. Jackson, and P. Taylor, The incidence of acute promyelocytic leukemia appears constant over most of a human lifespan, implying only one rate limiting mutation. Leukemia, 2000. 14(4): p. 722-6.
4. Sanz, M.A., et al., Management of acute promyelocytic leukemia: recommendations from an expert panel on behalf of the European LeukemiaNet. Blood, 2009. 113(9): p. 1875-91.
5. Sanz, M.A. and P. Montesinos, Open issues on bleeding and thrombosis in acute promyelocytic leukemia. Thrombosis research, 2010. 125 Suppl 2: p. S51-4.
6. Stein, E., et al., The coagulopathy of acute promyelocytic leukaemia revisited. Best practice & research. Clinical haematology, 2009. 22(1): p. 153-63.
7. Kwaan, H.C., J. Wang, and L.N. Boggio, Abnormalities in hemostasis in acute promyelocytic leukemia. Hematological oncology, 2002. 20(1): p. 33-41.
8. Ono, T., et al., Long-term outcome and prognostic factors of elderly patients with acute promyelocytic leukemia. Cancer science, 2012. 103(11): p. 1974-8.
9. Ades, L., et al., Very long-term outcome of acute promyelocytic leukemia after treatment with all-trans retinoic acid and chemotherapy: the European APL Group experience. Blood, 2010. 115(9): p. 1690-6.
10. Jacomo, R.H., et al., Clinical features and outcomes of 134 Brazilians with acute promyelocytic leukemia who received ATRA and anthracyclines. Haematologica, 2007. 92(10): p. 1431-2.
11. Tallman, M.S., et al., All-trans-retinoic acid in acute promyelocytic leukemia. The New England journal of medicine, 1997. 337(15): p. 1021-8.
12. Dmoszynska-Giannopoulou, A. and J. Kowalewski, [Present-day views on the role of blood platelets in hemostasis. I. Role of platelets in primary hemostasis]. Polskie Archiwum Medycyny Wewnetrznej, 1978. 60(2): p. 169-73.
13. Broos, K., et al., Platelets at work in primary hemostasis. Blood reviews, 2011. 25(4): p. 155-67.
14. Xin, L., et al., A survival study and prognostic factors analysis on acute promyelocytic leukemia at a single center. Leukemia research, 2007. 31(6): p. 765-71.
15. Tallman, M.S., et al., All-trans retinoic acid in acute promyelocytic leukemia: long-term outcome and prognostic factor analysis from the North American Intergroup protocol. Blood, 2002. 100(13): p. 4298-302.
16. Degos, L. and Z.Y. Wang, All trans retinoic acid in acute promyelocytic leukemia. Oncogene, 2001. 20(49): p. 7140-5.
17. Nadir, Y., et al., Hemostatic balance on the surface of leukemic cells: the role of tissue factor and urokinase plasminogen activator receptor. Haematologica, 2005. 90(11): p. 1549-56.
18. Rickles, F.R., et al., Bleeding and thrombosis in acute leukemia: what does the future of therapy look like? Thrombosis research, 2007. 120 Suppl 2: p. S99-106.