La prise en charge de l’hémophilie : état des lieux et perspectives à l’hôpital du Mali
SOUNTOURA Zakari1, DIALLO Yacouba L.1, KANE Bourama2, DRAME Boubacar Sidiki Ibrahim3, DEMBELE Bakari 4, DOUMBIA Nanko1, SOW Djeneba SYLLA1, TRAORE Aboubacar Sidiki 5, KONATE Massama1, OUOLOGUEM Nouhoum1, TRAORE Zoumana1, KONE Apho Sallé6, SIDIBE Assa TRAORE1
1: Service de Médecine Hôpital du Mali, Bamako, Mali, 2: Service de Pédiatrie, Hôpital du Mali, Bamako, Mali, 3: Laboratoire de Biologie, Hôpital du Mali, Bamako, Mali, 4: Administration Hôpital du Mali, Bamako, Mali, 5: Service de Médecine, Hôpital Somino DOLO, Sévaré. 6: Service de Radiothérapie, Hôpital du Mali, Bamako, Mali.
L’hémophilie est une maladie hémorragique congénitale rare associée au chromosome X. La mortalité et la morbidité restent élevées surtout dans les pays à ressources limitées. Depuis 2012 la prise en charge de l’hémophilie a connu une véritable évolution au Mali avec l’accès au diagnostic et au traitement avec des facteurs anti hémophiliques A ou B. Quoique salutaire, la prise en charge des hémophiles n’est pas encore efficiente au Mali. L’objet de ce travail était de faire un état des lieux dans l’optique de contribuer à améliorer la qualité de vie des malades.
Il s’agissait d’une étude transversale incluant les hémophiles A et B suivis à l’hôpital du Mali. Elle était à la fois rétrospective de 01 Juin 2014 01 Novembre 2017 et prospective 01 Novembre 2017 au 30 Septembre 2018. Les informations sur chaque patient ont été glanées sur des supports individuels à partir des dossiers des malades, la base des données de la Fédération Mondiale de l’hémophilie et le registre national des coagulopathies du Mali. Les données sociodémographiques et de biologie ont été saisies et analysées sur SPSS 21.0.
Sur 1216 patients pris en charge sur le plan hématologique, 123 étaient suivis pour syndrome hémorragique. Nous avons enregistrés 110 hémophiles soit 89.43% des syndromes hémorragiques. Il s’agissait dans 91.8% d’hémophiles A. Pendant la période de l’étude, 2 143 260 UI de concentrés de facteurs anti-hémophiliques ont été utilisés. Les hémarthroses constituaient la cause de consommation de facteurs anti hémophiliques dans 46%, suivies des hématomes (36%). Les complications et les rares cas de décès étaient exclusivement observés dans les formes sévères. Il existait une corrélation entre la survenue des accidents hémorragiques, les complications et la survenue des décès chez les malades soumis aux traitements préventifs (p=0.001).
Conclusion
La prise en charge de l’hémophilie connait des avancés encourageantes au Mali, mais il existe encore de nombreux défis à relever afin d’améliorer la qualité de vie des hémophiles sévères.
Hemophilia is a rare X linking congenital hemorrhagic disease, but mortality and morbidity remain high, especially in limited resources countries. Since 2012 the management of hemophilia has a real evolution in Mali with access to diagnosis and treatment with anti-hemophilic factors A or B. Although this progress, the management of hemophiliacs is not yet efficient in Mali. The purpose of this work was to make an inventory with the goal to improve patient’s life quality.
It was a cross-sectional study including hemophiliacs A and B followed at the Mali hospital. It was both retrospective from 01 June 2014 01 November 2017 and prospective 01 November 2017 to 30 September 2018. The information on each patient was gleaned on individual media from patient records, the database of the World Federation hemophilia and data from national coagulopathies registry. Sociodemographic and biology data were reported and analyzed with SPSS 21.0.
Of the 1216 patients treated in hematology department, 123 were followed for hemorrhagic syndromes. We have recorded 110 hemophiliacs through the hemorrhagic group (89.43%). It involved 91.8% of hemophiliacs A. During the study period, 2 143 260 IU antihemophilic factor concentrates were used. Haemarthrosis was the cause of consumption of anti-haemophilic factors in 46% followed by haematomas (36%). Complications and rare cases of death were exclusively observed in severe forms. There was a correlation between the occurrence of haemorrhagic events, complications and the occurrence of deaths in patients subjected to preventive treatments (p = 0.001).
Conclusion
The management of hemophilia is showing encouraging progress in Mali, but there are still many challenges to overcome in order to improve the quality of life of severe hemophiliacs.
Zakari SOUNTOURA, service de médecine, hôpital du Mali, 03 BP 106 Bamako, Mali. Email : Cette adresse e-mail est protégée contre les robots spammeurs. Vous devez activer le JavaScript pour la visualiser.
INTRODUCTION
L’hémophilie est une maladie hémorragique congénitale rare associée au chromosome X [1, 2]. Dans 30% des cas, il existe des formes sporadiques apparaissant dans une famille sans aucune histoire familiale d’hémophilie [3].
Il existe deux types d’hémophilie : l’hémophilie A due à un déficit en facteur VIII et l’hémophilie B due à un déficit en facteur IX de la coagulation. Sa prévalence est de 10 cas pour 100 000 naissances pour l’hémophilie A et 10 pour 200 000 pour l’hémophilie B [4].
Sur le plan clinique, l’hémophilie se caractérise par des saignements importants et prolongés en cas de blessure accidentelle ou provoquée que la gravité ne laisse apparaitre. La gravité des saignements est inversement proportionnelle à la quantité de facteur de coagulation circulant. Ainsi trois formes cliniques se distinguent. Les formes sévères ayant moins de 1 UI/ml, les formes modérées ayant un taux compris entre 1 et 5 UI/ml et les formes mineures avec un taux plasmatique compris entre 5 et 45 UI/ml [2]. Les saignements souvent imprévisibles, impliquent dans 70 à 80% les articulations à l’origine de séquelles invalidantes [5-7]. Cependant cette maladie attire peu l’attention des décideurs de part le faible taux de prévalence comparé aux maladies tropicales. Quoique rare, la mortalité et la morbidité restent élevées surtout dans les pays à ressources limitées [1, 8, 9]. D’après les données de la Fédération Mondiale de l’Hémophilie (FMH), 70% des hémophiles ne sont pas encore diagnostiqués dans le monde [1, 10]. Dans cette population, 90% vivent dans les pays à ressources limitées comme le nôtre [1]. La prise en charge de l’hémophilie est un véritable défi en Afrique tant sur le plan diagnostic que thérapeutique [1, 11-15] .
C'est une maladie peu connue du public malien et même souvent des professionnels de santé. Mais depuis 2012 la prise en charge de l’hémophilie a connu une véritable évolution au Mali avec la création de l’Association Malienne de Lutte contre l’Hémophilie et les autres Coagulopathies (AMALHEC) et sa reconnaissance par la FMH en 2014. Le diagnostic est maintenant accessible dans certains laboratoires publics et privés. De même avec l’appui de la FMH, la quasi-totalité des malades diagnostiqués bénéficient d’un traitement avec des facteurs anti hémophiliques A ou B selon le cas sous forme de prophylaxie primaire, secondaire voir de traitement à la demande [12]. Quoique salutaire, la prise en charge des hémophiles n’est pas encore optimale au Mali. L’objet de ce travail est donc de faire un état des lieux de la prise en charge des malades afin d’identifier les axes d’orientation futures permettant de contribuer à améliorer significativement la qualité de vie des malades.
MATERIEL ET METHODE
1. Patients :
Nous avons inclus dans cette analyse transversale tous les hémophiles A ou B suivis dans le service de Médecine et d’Endocrinologie de l’hôpital du Mali.
Le diagnostic biologique a été fait sur plasma issue de chaque patient au laboratoire de l’hôpital du Mali ou un laboratoire privé confirmé de la place. Les tests d’orientation comme le TP et le TCA, le TCA corrigé ont tous été réalisés avant le dosage des facteurs VIII et IX de la coagulation. A la suite, le type d’hémophilie A ou B a été déterminé pour chaque patient. De même les patients ont été repartis en fonction du taux sérique de facteur déficient en hémophile sévère (˂ I UI), hémophile modéré (compris entre 1 et 5 UI) et hémophile mineur (compris entre 5 et 45 UI).
Tous patients atteints d’une maladie hémorragique congénitale autre que l’hémophilie, les cas présumés d’hémophilie et les hémophiles qui n’ont pas donné leur accord, n’ont pas été retenus.
2. Méthode :
Nous avons réalisé une étude transversale à la fois rétrospective et prospective du 01 Juin 2014 au 01 Novembre 2017 et du 01 Novembre 2017 au 30 Septembre 2018. Les données cliniques et de biologie ont été collectées à partir des dossiers médicaux, le registre de consultation, la base de données du programme humanitaire de la FMH et du registre national des coagulopathies du Mali.
Les informations ont été ont été glanées sur des supports individuels, à partir des dossiers des patients de façon anonyme et confidentielle. L’analyse des données a été faite en respectant les mêmes principes de confidentialités et de respect de la vie privée des patients. Aucune information personnelle permettant d’identifier un patient n’a été divulgué. Pour les entretiens directs une autorisation verbale préalable a été demandée et obtenue auprès du malade (si majeur) ou à une autorité parentale dans le cas échéant (si le mineur).
Les différentes informations ont été saisies et analysées sur SPSS 21.0. Les moyennes ont été calculées avec un intervalle de confiance à 95 %. Une valeur de (p < 0,05) a été considérée comme significative.
RESULTATS
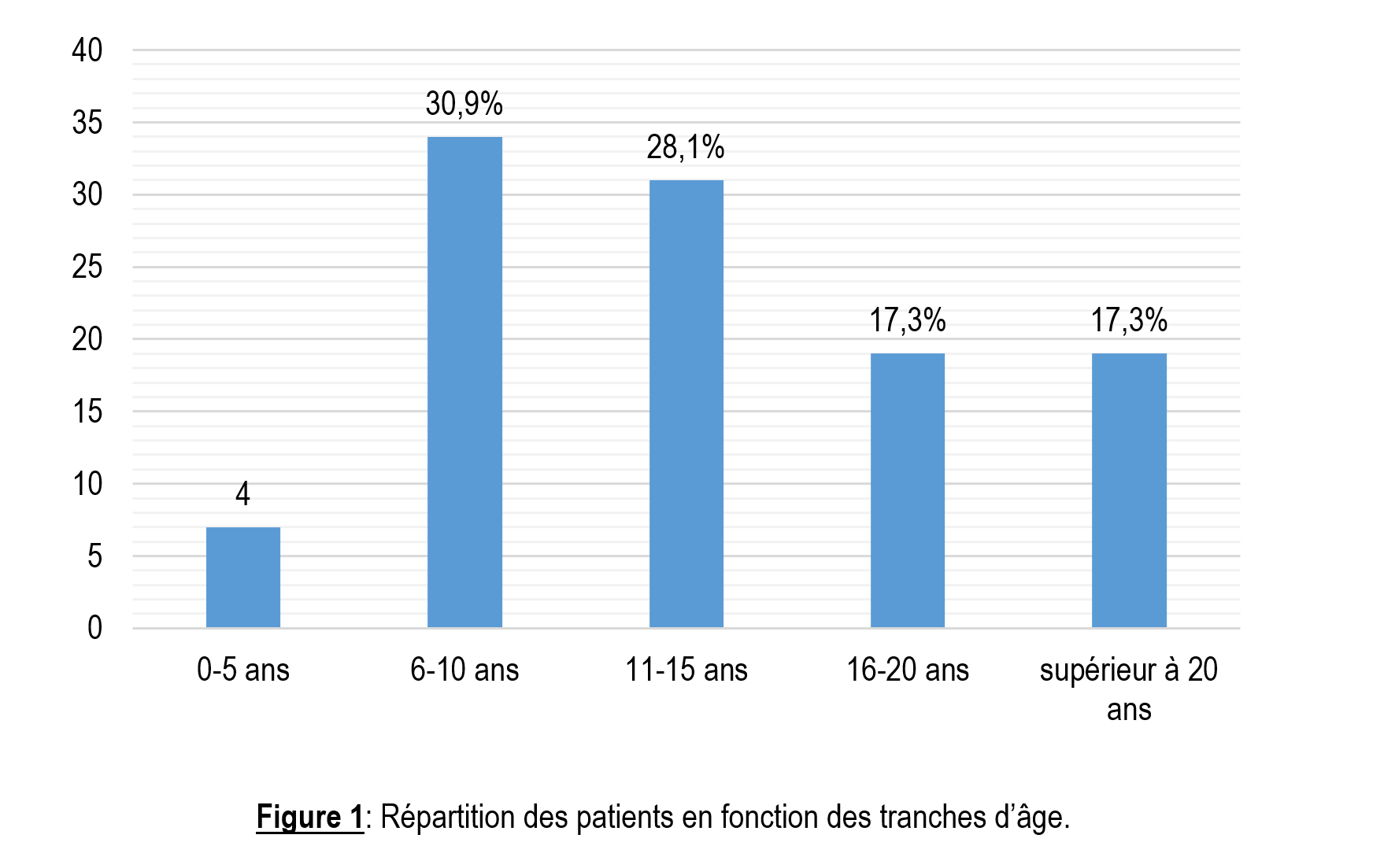
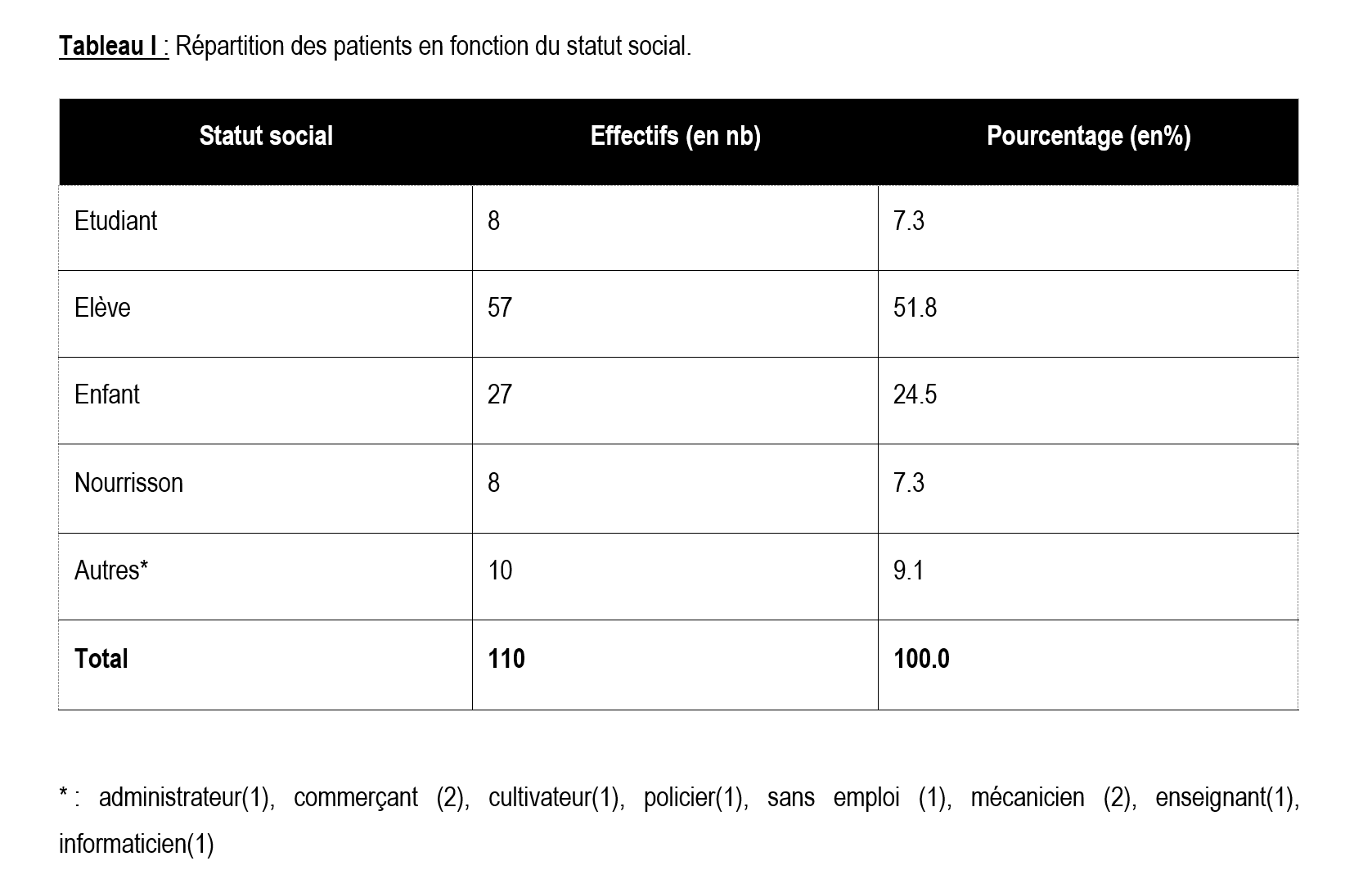
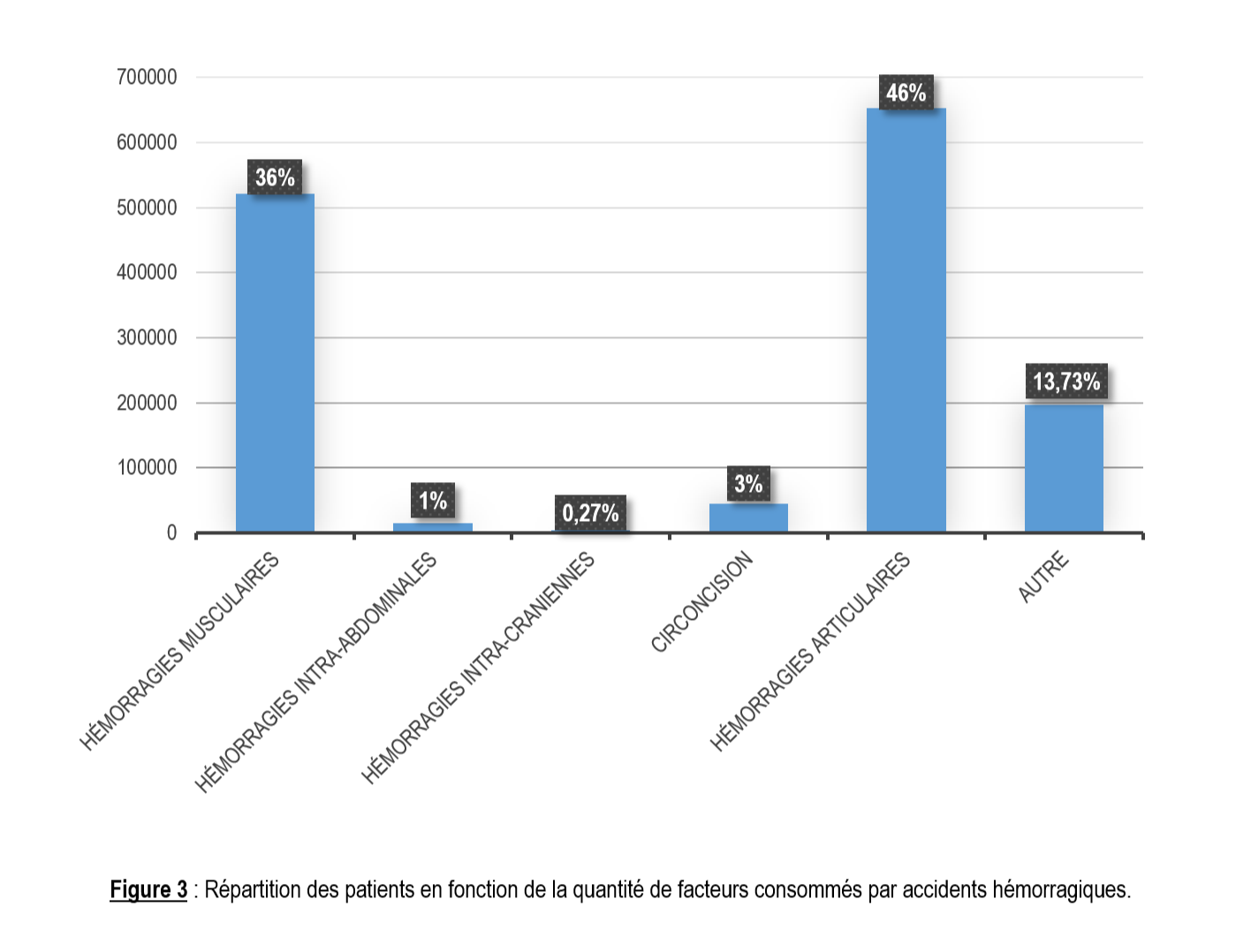
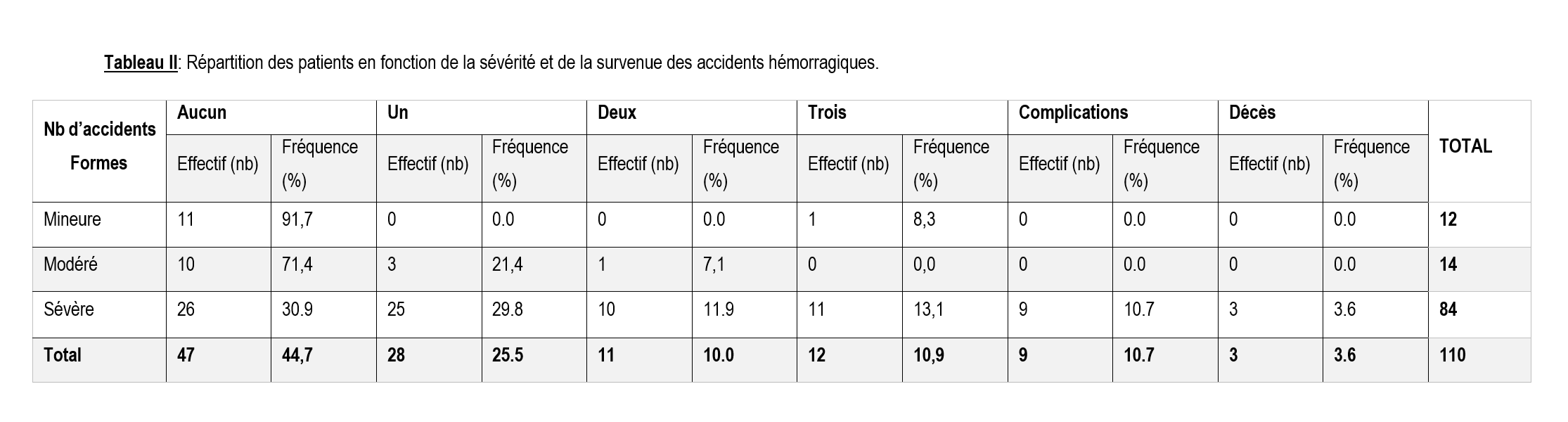
Du 01 Juin 2014 au 01 Novembre 2017 et du 01 Novembre 2017 au 30 Septembre 2018, 123 malades admis pour syndrome hémorragique sur 1216 patients vus en hématologie soit une fréquence de 10.11%. Dans cette population 110 hémophiles sur soit 89.43% des syndromes hémorragiques. Il s’agissait de 101 hémophiles A soit 91.8% et 9 hémophiles B soit 8.2%. La moyenne d’âge était 11.40 ±8.8 ans avec des extrêmes de 10 mois et 43 ans. Le sexe masculin représentait 92% de la population. Le sex-ratio était de 11. La tranche d’âge 6-10 ans représentait 30,9% de la cohorte (figure 1). Dans notre population les élèves représentaient 51,8% (tableau 1). En fonction de la sévérité, nous avons constaté que 77.3% des patients étaient des hémophiles sévères (figure 2). Nous avons observé 127 accidents hémorragiques. Il s’agissait de 117 hémorragies aigues dont essentiellement des hémarthroses aigues, des gingivorragies, des infections, des hémorragies intracrâniennes et des hématomes. Il y’avait 10 complications chroniques dont 7 arthropathies hémophiliques et 3 cas d’inhibiteurs anti facteur hémophilique A. Au total, 2 143 260 UI de concentrés de facteurs anti-hémophiliques ont été utilisés. Les hémarthroses étaient la cause de consommation de facteurs dans 46% des cas (figure 3). Nous avons observé que 44.5% des patients n’avaient fait aucun accident, 29.8% des formes sévères avaient fait au moins un accident hémorragique. Les complications et décès ont été observés exclusivement chez les hémophiles sévères. (X²=23.209, p=0.10) (tableau 2). Les accidents hémorragiques semblent précoces et fréquentes chez les nourrissons. Au cours du suivi nous avons observé que 42.72% des patients n’avaient fait aucun accident. Il s’agissait dans 60% de sujets de statut variés, suivi par les enfants (44.44%), d’élèves (42.10%) et de nourrissons (50.0%). Il existe une corrélation entre la survenue des accidents hémorragiques, complications et la survenue de décès chez les malades soumis aux différents traitements préventifs (tableau 3).
DISCUSSION
Le but de cette étude était de faire l’état des lieux de la prise en charge des hémophiles à l’hôpital du Mali afin d’identifier les forces et les faiblesses du schéma actuel. Il s’agissait d’une étude descriptive transversale à la fois rétrospective du 01 Juin 2014 au 01 Novembre 2017 et prospective du 01 Novembre 2017 au 30 Septembre 2018. Ce choix a l’avantage d’être assez large dans la collecte des données, même si le caractère rétrospectif peut être une limite dans la qualité des données collectées. Elle s’est déroulée dans le service de Médecine et d’Endocrinologie de l’Hôpital du Mali qui regroupe en son sein cinq spécialités dont l’hématologie. A l’hôpital du Mali, cette spécialité gère tous les cas d’hémopathie et particulièrement les cas d’hémophilie et autres troubles de la coagulation. Ceci justifie le choix de ce service pour conduire ce travail.
C’est une affection peu connue en général au Mali dont la prise en charge est confrontée à des difficultés financières pour les malades et leurs familles, à l’accès aux facteurs antihémophiliques et à l’insuffisance du plateau technique limitant les capacités de diagnostic à tous les niveaux [12]. Ces réalités non négligeables doivent être intégrées dans l’analyse de nos résultats.
Nous avons observé que 64% des malades avaient moins de 16 ans, ce qui conforte le caractère héréditaire de la maladie et le diagnostic précoce [16, 17]. En effet les symptômes cliniques de la maladie se manifestent très tôt dans la vie surtout quand l’enfant commence à marcher à quatre pattes [14]. Les zones de contacts avec le sol présentent très rapidement les signes d’hématomes pouvant alertés les parents à consulter les services spécialisés. Aussi un autre facteur est la précocité de la circoncision dans notre société et les antécédents de décès de garçons après cet acte [16].
Le sexe ratio H/F était de 11. Ce résultat est supérieur à celui de la FMH qui rapporte un sexe ratio de 5 [4]. Cette différence pourrait s’expliquer par la taille de notre cohorte et l’insuffisance des facilités de diagnostic. En effet le diagnostic de l’hémophilie n’est pas aisé chez les sujets de sexe féminin. Il faut souvent recourir à la génétique qui n’est pas accessible dans notre contexte [3].
Dans la cohorte, les élèves étaient plus représentés avec une fréquence de 51,8%. Ils étaient suivis par les enfants scolarisés 24.5% et les nourrissons 7.3%. Cela peut être dû au fait que plus de la moitié de la population était enfants, mais aussi que l’apparition des signes cliniques dès les premiers mois de la vie, favorise un diagnostic précoce. Dans les pays à ressources limitées, l’hémophilie apparait comme une maladie à sélection naturelle. En effet dans notre cohorte l’histoire naturelle de la maladie se caractérise par des antécédents de décès précoces de plusieurs garçons dans les familles d’hémophile [14, 18]. Beaucoup de parents qui sont déjà passés par cette expérience malheureuse consultent pour un diagnostic précoce.
L’hémophilie A représentait la quasi-totalité des patients (92,7%). Ce résultat corrobore aux données de la littérature car l’hémophilie A reste et demeure la plus fréquente à travers le monde (plus de 80 %) selon la FMH.
Les formes sévères représentaient 77.3% de nos patients. Cela peut s’expliquer par le fait que les accidents hémorragiques sont fréquents chez les hémophiles sévères et qui sont le mode révélateur de la maladie dans la plupart des temps [19]. Les complications et les décès étaient observés exclusivement chez les hémophiles sévères. Dans les formes sévères, les malades ont souvent des saignements graves et très prolongés. Les saignements sont rares dans les formes mineures. Ces malades ne saignent presque pas sauf en cas d’opération chirurgicale importante ou une blessure importante.
L’hémophilie se manifeste par des accidents hémorragiques, dont les plus fréquents intéressent l’appareil locomoteur [20, 21]. Dans notre étude ces accidents hémorragiques intéressaient les articulations dans 46%. Ce résultat est inférieur à celui de la FMH qui rapporte 70 à 80% d’atteintes articulaires chez les hémophile [20]. Cela pourrait s’expliquer par la taille de notre cohorte qui ne correspond qu’aux données d’une seule structure contrairement aux données de la FMH qui regroupent plusieurs pays. La forte prévalence des arthropathies hémophiliques s’explique par le fait que 90% des hémophiles vivent dans les pays à ressource limitée comme le nôtre où ils n’ont pas accès aux facteurs antihémophiliques [1]. Ceci motive la recommandation de la mise sous prophylaxie primaire précoce des hémophiles sévères pour éviter la survenue des complications handicapantes [22]. Nous avons observé que les hémophiles mineures et les modérés font moins d’accidents hémorragiques (86.1%) et rarement des complications. Par contre les formes sévères font plus d’accidents et de complications que les autres malades. La forme sévère augmente le risque de survenue des accidents hémorragiques et les complications avec un (p=0.001). Nos données confirment cette corrélation entre la sévérité, la fréquence des accidents hémorragiques et la survenue des complications.
Nous avons observé que le traitement préventif était bénéfique pour les malades. Initiés au premier accident hémorragique, nous avons observé une diminution du nombre de patients qui faisaient plus de deux accidents hémorragiques et des complications à partir de l’initiation de la prophylaxie [23].
La prévention secondaire était initiée chez 70% de patients qui avaient déjà présenté trois accidents hémorragiques et 20% qui présentaient des complications. Ceci témoigne du caractère tardif du diagnostic de la maladie dans notre cohorte. A la lumière de nos résultats, il parait encore nécessaire de fournir plus d’efforts pour améliorer la qualité de vie des hémophiles maliens.
1. O'Mahony, B. and C. Black, Expanding hemophilia care in developing countries. Seminars in thrombosis and hemostasis, 2005. 31(5): p. 561-8.
2. Bolton-Maggs, P.H.B., Optimal haemophilia care versus the reality. British Journal of Haematology, 132, 671–682, 2005. 132: p. 671-682.
3. Seck, M., et al., Molecular diagnosis of haemophilia A in patients from Senegal. Haemophilia, 2017. 23(3): p. e225-e227.
4. WFH, Annual global survey 2016. 2017.
5. Lobet, S., C. Detrembleur, and C. Hermans, Impact of multiple joint impairments on the energetics and mechanics of walking in patients with haemophilia. Haemophilia, 2013. 19(2): p. e66-72.
6. Beyan, C., K. Kaptan, and A. Ifran, Hemophilic arthropathy in non-severe hemophiliacs. Rheumatology international, 2007. 27(5): p. 501-2.
7. Aledort, L.M., R.H. Haschmeyer, and H. Pettersson, A longitudinal study of orthopaedic outcomes for severe factor-VIII-deficient haemophiliacs. The Orthopaedic Outcome Study Group. Journal of internal medicine, 1994. 236(4): p. 391-9.
8. Kashyap, R. and V.P. Choudhry, Management of hemophilia in developing countries. Indian journal of pediatrics, 2001. 68(2): p. 151-7.
9. Darby, S.C., et al., Mortality rates, life expectancy, and causes of death in people with hemophilia A or B in the United Kingdom who were not infected with HIV. Blood, 2007. 110(3): p. 815-25.
10. Isarangkura, P., Haemophilia care in the developing world: benchmarking for excellence. Haemophilia, 2002. 8(3): p. 205-10.
11. Adewuyi, J.O., et al., Haemophilia care in Zimbabwe. The Central African journal of medicine, 1996. 42(5): p. 153-6.
12. Diallo YL, et al., Hemophilia management in development countries is a big challenge. Haemophilia, 2014. 20 (Suppl. 3, ): p. 125.
13. Giangrande, P.L. and C. Black, World Federation of Haemophilia programs in developing countries. Seminars in thrombosis and hemostasis, 2005. 31(5): p. 555-60.
14. Diop, S., et al., [Pattern of type A hemophilia in Senegal: prospective study in 54 patients]. Transfus Clin Biol, 2003. 10(1): p. 37-40.
15. Balogog, P.N., et al., FVIII and FIX inhibitors in people living with hemophilia in Cameroon, Africa: a preliminary study. Int J Lab Hematol, 2014. 36(5): p. 566-70.
16. Seck, M., et al., Circumcision in hemophilia using low quantity of factor concentrates: experience from Dakar, Senegal. BMC Hematol, 2017. 17: p. 8.
17. Gouider, E., et al., Real-life evidence in evaluating effectiveness of treatment in Haemophilia A with a recombinant FVIII concentrate: a non-interventional study in emerging countries. Haemophilia : the official journal of the World Federation of Hemophilia, 2015. 21(3): p. e167-75.
18. Young, G., New challenges in hemophilia: long-term outcomes and complications. Hematology Am Soc Hematol Educ Program, 2012. 2012: p. 362-8.
19. Serban, M., et al., Risks and challenges of orthopaedic invasive interventions in haemophilia in a low-resource country. A single-center experience. Hamostaseologie, 2014. 34 Suppl 1: p. S30-5.
20. Luck, J.V., Jr., et al., Hemophilic arthropathy. J Am Acad Orthop Surg, 2004. 12(4): p. 234-45.
21. Rezazadeh, S., et al., Synoviorthesis induced by rifampicin in hemophilic arthropathy: a report of 24 treated joints. Ann Hematol, 2011. 90(8): p. 963-9.
22. van den Berg, H.M., et al., Long-term outcome of individualized prophylactic treatment of children with severe haemophilia. British journal of haematology, 2001. 112(3): p. 561-5.
23. Manco-Johnson, M.J., et al., Prophylaxis versus episodic treatment to prevent joint disease in boys with severe hemophilia. The New England journal of medicine, 2007. 357(6): p. 535-44.