Evaluation ISO 15189 des non-conformités de la phase pré-analytique en hémostase au laboratoire de biologie médicale du CHU Hôpital du Mali
Yacouba L. DIALLO1, Boubacar SI DRAME2, Mamadou DIALLO2, Mamadou TOGO3, Yaya GOITA2, Halidou Moussa KONE2, Aimé Cesaire KALAMBRY2, Ambara KASSOGUE2, Adama KONE2, Aboubacar S. TRAORE4, Sow Djeneba SYLLA1, Nanko DOUMBIA1, Massama KONATE1, Nouhoum OUOLOGUEM1, Charles DARA1, Garan DABO1, Zoumana TRAORE1, Aphou Sallé KONE5, Idrissa M. DIARRA5, Konimba DIABAT5, Adama DIAKITE5, Mody TRAORE 6, Bakary DEMBELE6, Sanata SOGOBA6, Souleymane THIAM7, Korotoumou Wellé DIALLO8.
1: Service de médecine et d’endocrinologie, Hôpital du Mali, Bamako, Mali, 2: Laboratoire de biologie médicale, Hôpital du Mali, Bamako, Mali, 3: Institut National de Formation en Science de la Santé, Bamako, Mali, 4: Service de médecine, Hôpital Somino DOLO, Sévaré, Mali, 5: Service de Radiothérapie, Hôpital du Mali, Bamako, Mali, 6: Service santé publique, Hôpital du Mali, Bamako, Mali. 7: Service de chirurgie, Hôpital de Gao, Mali, 8: Service de pédiatrie, Hôpital du Mali, Bamako, Mali
Les erreurs de la phase pré-analytique, sont responsables de près de 70% d’erreurs diagnostiques. L’objectif principal de ce travail était d’étudier les non-conformités qui surviennent pendant la phase pré-analytique en hémostase dans un laboratoire engagé dans une démarche d’accréditation ISO-15189. Il s’agissait d’une étude prospective et descriptive des non-conformités de la phase pré-analytique. Elle a consisté à étudier l’ensemble des erreurs identifiées sur les demandes d’examen de laboratoire du 16 Aout au 15 Septembre 2021. En plus des demandes, l’étude a concerné tous les échantillons admis dans le laboratoire, les gestes du personnel impliqué dans la phase pré-analytique. Les anomalies sur les demandes d’examen, le niveau de remplissage, la qualité et le prétraitement des tubes utilisés, ont été étudiés. La moyenne a été calculée à l’aide du logiciel SPSS 21.0. Les résultats ont été exprimés en moyenne ±SD.
Pendant la période d’étude, 120 demandes ont été analysées. Nous avons recensé globalement 314 cas de non-conformités, qui sont essentiellement les erreurs de prescriptions dont 38,98% chez les patients hospitalisés, l’absence de précision sur l’heure de prélèvement et de renseignement clinique dans respectivement 27,1% et 11,8% des cas. Les anomalies associées au prélèvement représentaient 61,1% des cas de non-conformités.
Conclusion : Le respect des conditions pré-analytiques constitue un volet majeur dans la fiabilité et la validité des résultats en hémostase. Cette étude a mis en exergue quelques insuffisances qui nécessitent l’initiation d’actions et d’activités correctives impliquant tous les acteurs de la chaine de traitement des échantillons des analyses en hémostase.
The errors occurring during the pre-analytical phase are responsible for nearly 70% of diagnostic errors. The main objective of this work was to study the non-conformities that occur during the pre-analytical phase in hemostasis in a laboratory engaged in an ISO-15189 accreditation process. This was a prospective and descriptive study of the nonconformities of the pre-analytical phase. It consisted in studying all the errors identified on the laboratory examination demands from August 16 to September 15, 2021. In addition to the demands, the study concerned all the samples admitted into the laboratory, the actions of the personnel involved in the pre-analytical phase. Anomalies in examination demands, fill level, quality and pre-treatment of the tubes used were investigated. The data means was calculated using SPSS 21.0 software.
During the study period, 120 demands were analyzed. Overall, we identified 314 cases of non-conformities, which are mainly prescription errors, including 38,98 % of hospitalized patients, the lack of precision on the time of sampling in 27,1%, the absence of clinical information in 11,8% cases. The abnormalities associated to the sample prelevement were 61.1% of the cases of non-conformities.Conclusion: Compliance with pre-analytical conditions constitutes a major component in the reliability and validity of results in hemostasis. This study highlighted a few shortcomings that require the initiation of corrective actions and activities involving all the players in the chain of processing samples for hemostasis analyzes.
Yacouba DIALLO, Hématologue-chercheur, service de médecine, Hôpital du Mali. Téléphone : +22370519917, Email : Cette adresse e-mail est protégée contre les robots spammeurs. Vous devez activer le JavaScript pour la visualiser., BP : 03BP106, Bamako, Mali.
Introduction
La non-conformité pré-analytique se définie comme tout écart d’application qui peut entrainer des conséquences sur la fiabilité des résultats entre les dispositions prévues dans les documents définis par le laboratoire de biologie médicale qui s’applique à la phase pré-analytique et à l’ensemble des processus. Cette non-conformité doit être notifiée et enregistrée [1]. La prise en charge d’un prélèvement en biologie médicale comporte trois grandes phases distinctes et enchainées dans le temps : les phases pré-analytique, analytique et post-analytique. Selon les données rapportées dans la littérature, les erreurs pré-analytiques représentent environ près de 70% de toutes les erreurs survenant dans le laboratoire, constituant un danger et une perte de temps pour le patient, ainsi qu’un surcoût [1-3]. Il est nécessaire de respecter les procédures recommandées, afin de limiter les erreurs qui pourraient jouer sur la fiabilité des résultats. La maitrise des procédures de la pré-analytique et des autres causes d’erreurs est essentielle pour la fiabilité des rendus des résultats du laboratoire [1].
Depuis sa création, le laboratoire de biologie médicale de l’Hôpital du Mali, est engagé dans une démarche constante d’amélioration de la qualité des résultats des examens de laboratoire, particulièrement ceux des tests d’hémostase. C’est ainsi que depuis 2014, elle est inscrite sur le programme international de contrôle qualité de la Fédération Mondiale de l’Hémophilie (IEQAS). En 2020, elle s’est engagée dans une démarche de certification selon les normes ISO-15189.
L’évaluation de la qualité de la phase pré-analytique des examens d’hémostase est une étape importante du processus. Il nous est apparu nécessaire d’initier ce travail dans le but de faire un état des lieux, permettant d’identifier les anomalies pouvant jouer sur la qualité des résultats et impacter ce processus d’accréditation. Le but de cette étude était de relever les principales anomalies de la phase pré-analytique des demandes d’examen d’hémostase au niveau laboratoire de l’Hôpital du Mali, afin de proposer des solutions visant à les corriger.
Matériel et méthode :
Il s’agissait d’une étude descriptive à recrutement prospectif, conduite dans le laboratoire d’analyse de biologie médicale et d’anatomo-pathologie de l’Hôpital du Mali. L’Hôpital du Mali crée par la loi n°10-010 du 20 mai 2010 est le fruit de l’amitié entre la Chine et le Mali. C’est un hôpital de 3ème référence, qui s’impose comme un pôle de référence nationale dans la prise en charge des maladies de l’hémostase.
Nous avons analysé toutes les demandes d’examen d’hémostase adressées au laboratoire du 16 aout 2021 au 15 septembre 2021 soit quatre semaines. Elle a été conduite sous forme d’une enquête, relevant les principales erreurs liées à la phase pré-analytique. L’ensemble des paramètres de la phase pré-analytique, ont été colligés sur une fiche d’enquête individuelle. Il s’agissait des informations sur :
- L’origine des prélèvements,
- Les erreurs d’identification des échantillons,
- Les discordances entre l’identité sur le bulletin d’analyse et l’étiquetage du tube,
- Les données sur les paramètres sociodémographiques,
- L’absence de renseignement clinique et thérapeutique,
- L’absence d’information sur l’heure de prélèvement,
- L’utilisation de tubes inappropriés,
- Le non-respect de l’ordre des prélèvements,
- Le non-respect du volume (ratio anticoagulant/sang non respecté),
- La présence de coagulum dans les tubes ainsi que les échantillons hémolysés.
|
Z1-α/2 2 p (1-p) d2 |
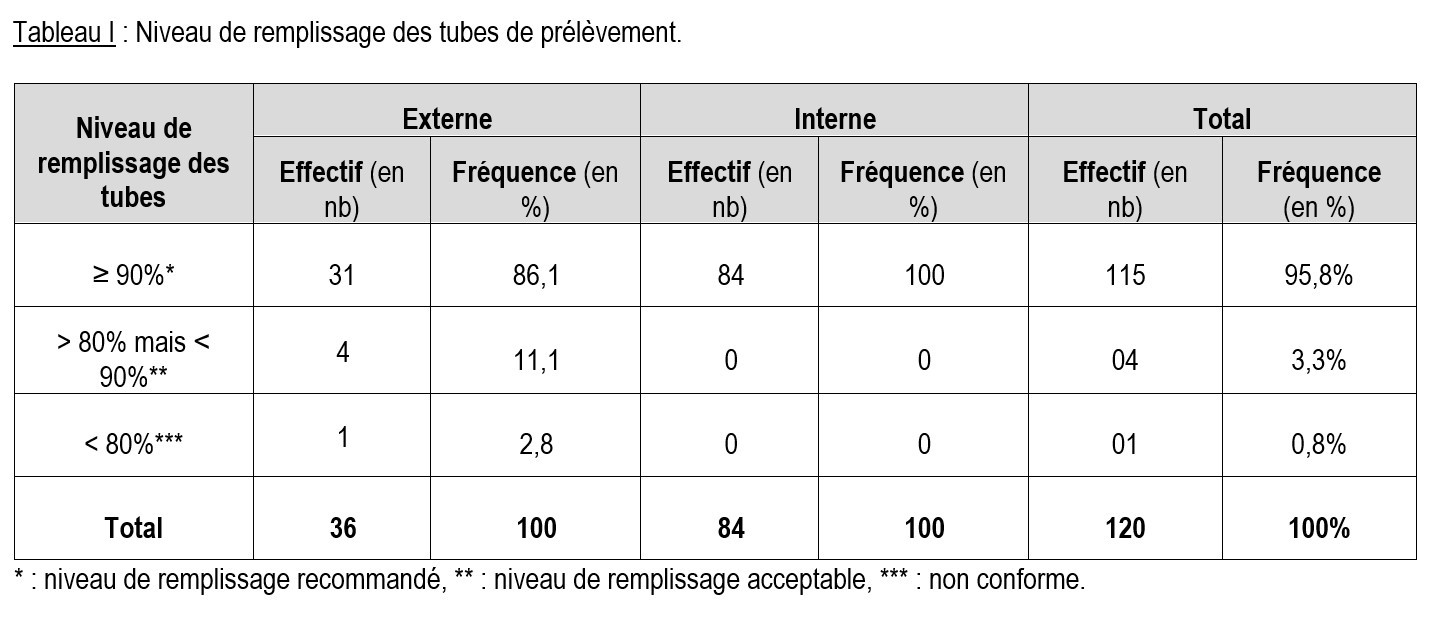
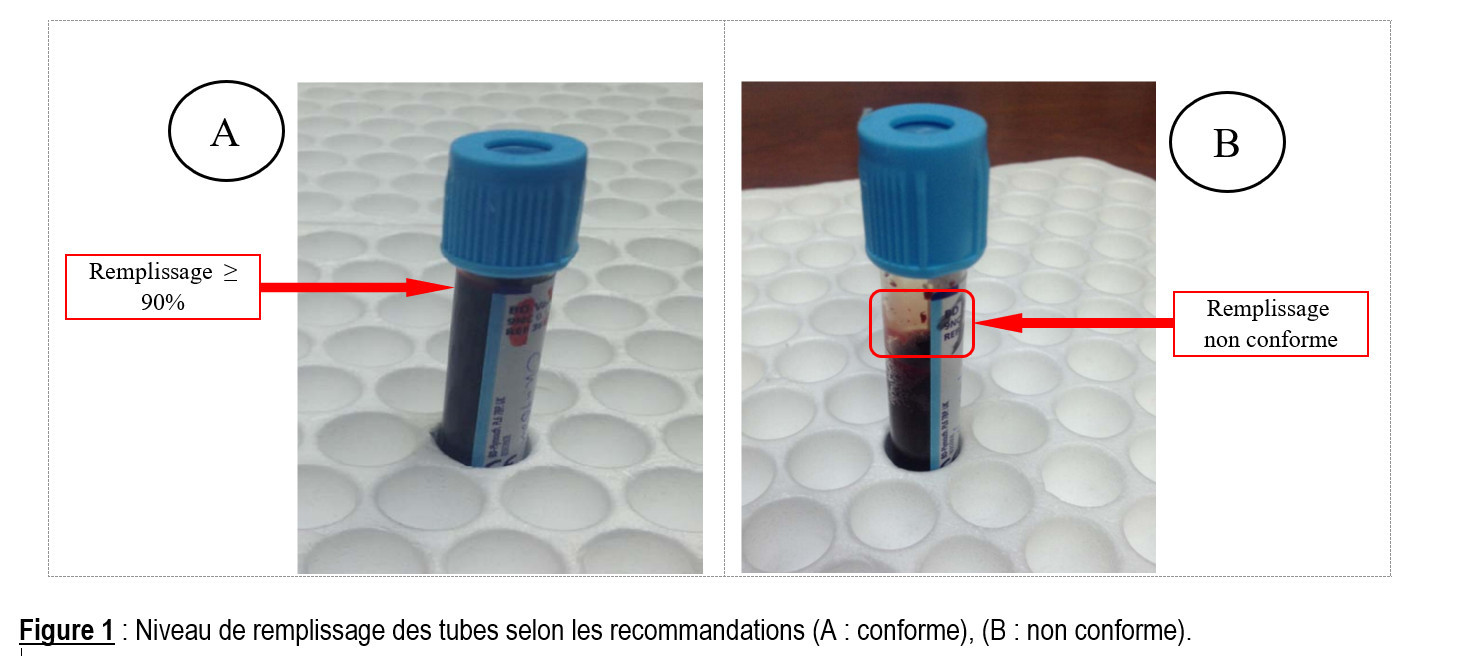
Le niveau de remplissage des tubes est définit en trois groupes : niveau de remplissage recommandé quand le niveau de remplissage est ≥ 90%, quand le niveau de remplissage est compris entre 80% et 90% le niveau de remplissage est dit acceptable. Ce niveau est dit non conforme quand le niveau est < 80% [4].
La taille de l’échantillon a été calculé avec la formule suivante : taille = [5].
Les données ont été saisies et analysés sur SPSS 21.0. Les résultats ont été exprimés en moyenne, et les variables ont été comparées entre elles. Les tests de corrélation statistiques (chi-2 et t de Student) ont été utilisés pour les rapports de corrélation entre les variables. Un p <0,05 a été considéré comme significatif.
Sur le plan éthique, la liberté de participer volontairement a été respectée de même que le respect de l’anonymat dans le traitement et la divulgation des résultats.
Résultats :
Pendant la période de l’étude, 120 demandes ont été analysées. Nous avons recensé globalement 314 cas de non-conformités. Aucune discordance d’identification entre les fiches et l’étiquetage des tubes n’a été enregistrée. Le sexe des patients n’était pas mentionné dans 11,7% des cas soit (14/120). L’âge était absent sur 35 bulletins soit 29,2% des cas.
Les renseignements cliniques et les informations sur les traitements reçus ou en cours étaient mentionnés dans 82,5% des cas. De même l’identité du prescripteur et du préleveur, n’étaient pas déterminées respectivement sur 19 bulletins (15,8%) et 87 cas soit 72,5%.
Sur les 120 demandes reçus au laboratoire, 84 (70,0%) étaient réalisés au niveau de la salle de prélèvements du laboratoire et 36 (30,0%) étaient prélevés au niveau des unités d’hospitalisation.
Dans notre série, l’heure exacte du prélèvement n’était pas mentionnée dans 60% des cas.
A l’issue de l’interrogatoire du personnel, l’ordre des prélèvements a été respecté pour les prélèvements effectués au niveau de la salle de prélèvement. Par contre cette information n’a pu être collectée pour les 36 prélèvements venus de l’extérieur du laboratoire.
L’examen visuel des tubes a permis de comprendre que le niveau de remplissage des tubes (figure 1), était respecté dans 95,8% des cas (tableau 1).
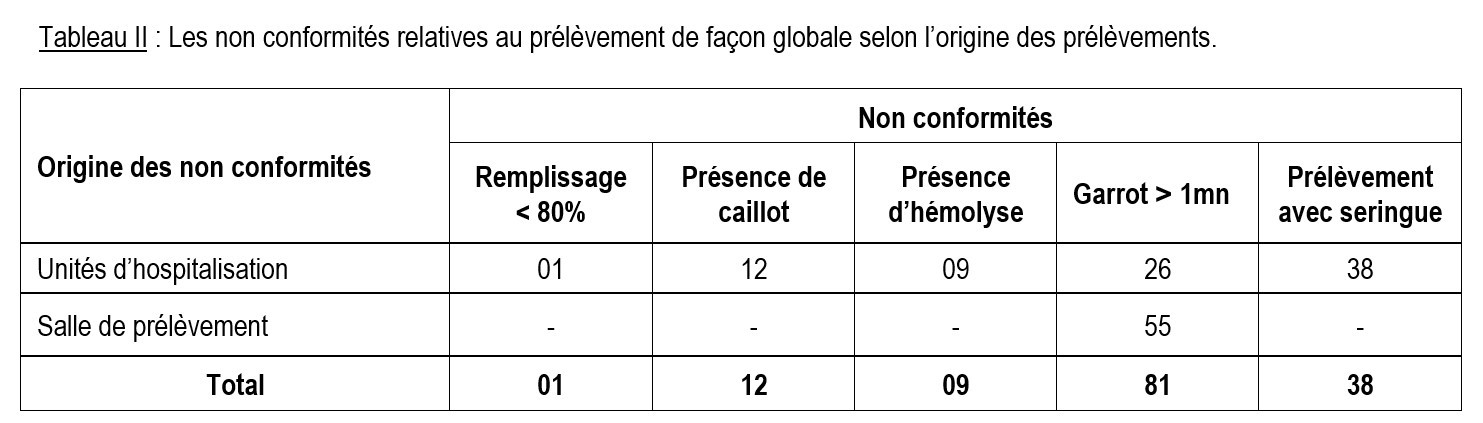
Nous avons réalisé qu’un coagulum était présent dans 12 tubes soit 10% des cas. Neuf prélèvements (09) soit 7,5% des échantillons, parmi lesquels 4 soit (44,5%) provenaient du service de la Réanimation, 3 soit (33,3%) provenaient du service des Urgences et 2 soit (22,2%) de la Pédiatrie. Les autres conformités sont résumées dans le tableau (II).
Sur 141 cas de non conformités le temps de pose du garrot ˃ 1mn a été retrouvé 81 fois soit 57,4% des cas, les prélèvements avec la seringue 38 fois (27,0%). La présence de caillot dans les échantillons et le remplissage non conforme des tubes ont été retrouvés respectivement dans 8,5% et 0,7% des cas.
Discussion :
L’identification préalable des prélèvements, est une étape fondamentale dans le rendu de résultats fiables. Les données doivent être conformes aussi bien sur les supports techniques que sur les échantillons prélevés. Une démarche qualité ne saurait occulter cette étape, d’où la nécessité de faire un état des lieux. Toute erreur d’identification d’un échantillon doit conduire au rejet systématique dudit échantillon.
Dans cette étude aucune erreur d’identification n’a été objectivée, ce qui témoignage d’une rigueur des prescripteurs et du service d’accueil et d’étiquetage des échantillons au niveau du laboratoire. Pourtant la littérature rapporte plusieurs anomalies de la pré-analytique, associées à ce paramètre. Ces erreurs varient entre 0,003 et 0,35% en fonction des études [6-10].
La détermination de l’âge et du sexe des patients, est un facteur non négligeable dans l’analyse et l’interprétation des tests d’hémostase [11]. Cependant ce paramètre n’est pas toujours rapporté sur les bulletins. Dans notre série, ce paramètre n’est pas renseigné dans 11,7% des cas, comme dans la série rapportée en 2018 par Tadesse H. et al [7] qui ont rapportés une non-conformité associée à ce paramètre dans 10,3% des cas. Les valeurs de référence utilisées lors de l’interprétation des bilans d’hémostase sont liées étroitement aux tranches d’âge des patients. La mention de l’âge ou la date de naissance est primordiale pour une interprétation adéquate des résultats [12-15]. Nous avons relevé l’absence de ce paramètre dans 29,2% des cas.
Les données de l’hémostase sont influencées par certains états pathologiques comme les maladies congénitales de l’hémostase, l’insuffisance hépatocellulaire, l’insuffisance rénale chronique, le diabète, l’obésité, etc., certains états physiologiques comme la grossesse, la prise de certains médicaments (anticoagulant, antiagrégant plaquettaire, les anti-inflammatoires, etc), etc. [1, 11, 16-20]. Donc la mention des renseignements cliniques et thérapeutiques sur les fiches de prescription des patients est très importante dans l’interprétation des résultats. Nous avons enregistré cette non-conformité dans 17,5% des cas. C’est une erreur courante rapportée par la littérature. Ainsi Tadesse H et al [7], en ont rapportés dans 70,1% des cas. Pourtant pour une meilleure interprétation des résultats, il faut des renseignements cliniques précis et exhaustifs.
La mention de l’heure du prélèvement est obligatoire afin de connaitre le délai exact entre la réalisation de prélèvement et sa réception pour traitement.
Le délai est un paramètre non négligeable dans la post analytique. D’après les recommandations des groupes d’experts du CLSI (The Clinical & Laboratory Standards Institute), le GFHT (Groupe Français d’Etude sur l’Hémostase et la Thrombose) et l’ECAT (European Concerted Action on Thrombosis), les prélèvements du sang total ou le plasma, conservés à la température ambiante (15⁰C - 25⁰C) pour les tests d'hémostase de routine ou la détermination des facteurs de coagulation, doivent être analysés dans les 4 heures suivant le prélèvement, à l'exception du TP, ayant une stabilité pouvant aller jusqu'à 24 heures, et des tests visant à surveiller les traitements avec l'héparine non fractionnée, pour lesquels le délai ne doit pas dépasser 2 heures [21, 22]. Souvent ce paramètre manque sur les demandes d’examen. Dans notre série, l’heure exacte du prélèvement n’était pas mentionnée dans 60,0% des cas. Pour
l’équipe de Ye Y. et al [6], qui a rapporté un taux de 0,001% de dépassement de délai entre la réalisation du prélèvement et la réception des tubes dans la salle de traitement, le traitement rapide des prélèvements contribue à minimiser de façon générale les rejets dus aux erreurs pré-analytiques. Cette réalité ne semble pas être bien perçue au niveau de nos unités d’hospitalisation, car ce paramètre n’a pu être évalué à cause de l’absence d’informations sur l’heure exacte du prélèvement. Il s’agit d’un problème majeur, dont les conséquences peuvent porter préjudice aux patients, ayant des prélèvements reçus après dépassement des délais acceptables car les résultats peuvent être erronés.
La méthode de prélèvement recommandée est la méthode sous vide avec un system vacutainer®.
Dans notre série, seuls les prélèvements effectués au laboratoire ont réalisés sous vide tandis que les échantillons prélevés au sein des services d’hospitalisation sont réalisés à l’aide d’une seringue. C’est un facteur qui pourrait expliquer la fréquence élevée des coagulums observés dans cette étude. Ceci traduit la nécessité d’actions urgentes pour corriger cette erreur évitable de la pré-analytique. Il n’est pas évident que le respect de l’ordre des tubes qui est capital dans la procédure, soit aussi respecter dans les unités d’hospitalisation, puisque ce paramètre n’a pu être évalué dans notre étude. Selon les recommandations du GFHT et du CLSI, le tube d’hémostase doit être prélevé en deuxième position après un tube sec de « purge » ou après le prélèvement des flacons d’hémoculture [11, 21].
Le respect du niveau de remplissage des tubes est un élément déterminant dans la qualité des résultats des tests d’hémostase. Selon les dernières recommandations du GFHT (Mai 2017), trois niveaux de remplissage sont à considérer.
- Recommandé : jusqu’à l’indice marqué sur le tube, ou à plus de 90%,
- Acceptable : tube rempli à plus de 80% et moins de 90%,
- Non conforme : tube rempli à moins de 80 %.
Les tubes à remplissage non conforme représentaient 0,83% de la totalité des tubes prélevés. Pour les tubes provenant des unités d’hospitalisation, 2,77% étaient non conformes. Ceci semble être un problème commun, qui est couramment rapporté dans la littérature. En effet les auteurs rapportent un taux compris entre 0,02 et 10,5% de cette non-conformité. Ceci pourrait expliquer le taux de 10% d’échantillons contenant un coagulum.
Conclusion
Le respect des conditions pré-analytiques constitue un volet majeur dans la fiabilité et la validité des résultats en hémostase. Cette étude a mis en exergue quelques insuffisances qui nécessitent l’initiation d’actions et d’activités correctives impliquant tous les acteurs de la chaine de traitement des échantillons des analyses en hémostase.
- Fraga HC, et al: Evaluation of the implementation of a quality system in a basic research laboratory: viability and impacts. . Einstein (Sao Paulo), 2012. 10(4): p. 491-7.
- Mauge L, and M. Alhenc-Gelas: [Stability of coagulation parameters: review of available data]. Ann Biol Clin (Paris), 2014. 72(2): p. 141-5.
- Bonnemaire JP: GBEA et phase pré-analytique, un exemple en Labm de ville. Spectra Biologie, 1999. 18(100): p. 21.
- Recommandations du Groupe d'Etudes sur l'Hémostase et la Thrombose (GEHT). Les variables préanalytiques en hémostase. Montrouge. John Libbey Eurotext, STV, 1998. numéro spcial (février vol 10).
- Charan, J and Biswas T: How to calculate sample size for different study designs in medical research? Indian J Psychol Med, 2013. 35(2): p. 121-6.
- Ye Y, et al: Haematology specimen acceptability: a national survey in Chinese laboratories. Biochem Med (Zagreb), 2018. 28(3): p. 030704.
- Tadesse, H, et al: Errors in the Hematology Laboratory at St. Paul's Hospital Millennium Medical College, Addis Ababa, Ethiopia. BMC Res Notes, 2018. 11(1): p. 420.
- Khayati S, et al: Pre-analytical Phase in Hemostasis: The Main Anomalies and Means to Correct Them. American Journal of Laboratory Medicine. , 2019. 4(6): p. 105-110.
- Gris J: Étapes préanalytiques en hémostase”. EMC - Biologie médicale. 2011 ;6(3) Janv :1–7.Biologie médicale, 2011. 6(Janvier).
- HarsimranKaur VN, et al: Preanalytical Errors in Hematology Laboratory- an Avoidable Incompetence. Iran J Pathol, 2016. 11(2): p. 151-4.
- Hézard, N: Hémostase pédiatrique. Bio Tribune Magazine, 2006. 18(1): p. 40-43.
- Hurtaud-Roux MF, Vincenot A: L’hémostase en pédiatrie, ses particularités, les principales pathologies hémorragiques et leur gestion. . Anesthésie & Réanimation, 2018. 4(4): p. 290-9.
- Dominique L, and Marie-Françoise H: Particularités de l’hémostase du nouveau-né. . Revue Francophone des Laboratoires, 2019. 508(Janvier): p. 72-80.
- Franchini M: Hemostasis and aging. Crit Rev Oncol Hematol, 2006. 60(2): p. 144-51.
- Magnette A, et al: Pre-analytical issues in the haemostasis laboratory: guidance for the clinical laboratories. Thromb J, 2016. 14: p. 49.
- Ozier Y, Cadic A, and Dovergne A: [Management of hemostasis abnormalities in patients with liver failure]. Transfus Clin Biol, 2013. 20(2): p. 249-54.
- Hunt BJ: The effect of BMI on haemostasis: Implications for thrombosis in women's health. Thromb Res, 2017. 151 Suppl 1: p. S53-S55.
- Madan R, et al: Coagulation profile in diabetes and its association with diabetic microvascular complications. J Assoc Physicians India, 2010. 58: p. 481-4.
- Linskens EA and Devreese, Pre-analytical stability of coagulation parameters in plasma stored at room temperature. Int J Lab Hematol, 2018. 40(3): p. 292-303.
- Sobczak AIS and Stewart AJ: Coagulatory Defects in Type-1 and Type-2 Diabetes. Int J Mol Sci, 2019. 20(24).
- Cornes, M., et al., Order of blood draw: Opinion Paper by the European Federation for Clinical Chemistry and Laboratory Medicine (EFLM) Working Group for the Preanalytical Phase (WG-PRE). Clin Chem Lab Med, 2017. 55(1): p. 27-31.
- Toulon P, et al: Impact of different storage times at room temperature of unspun citrated blood samples on routine coagulation tests results. Results of a bicenter study and review of the literature. Int J Lab Hematol, 2017. 39(5): p. 458-468.