Première expérience de diagnostic biologique du lupus anticoagulant à Ouagadougou au Burkina Faso.
MINOUNGOU/OUATTARA Aminata1, SAWADOGO Salam2,*, NEBIE Koumpingnin2, NIKIEMA/MINOUNGOU Myriam3, SANOU Aboubacar4, KAFANDO Eléonore2.
1 Centre hospitalier régional de Ziniaré, Burkina Faso, 2 : Laboratoire d’hématologie, Université Joseph KI-ZERBO, Ouagadougou, Burkina Faso, 3 : Centre hospitalier universitaire Yalgado OUEDRAOGO, Ouagadougou, Burkina Faso. 4 : Centre hospitalier régional de Banfora, Burkina Faso.
Le syndrome des anticorps anti-phospholipides est associé aux complications et issues défavorables de la grossesse en Afrique sub-saharienne. Toutefois, du fait de la faible capacité des laboratoires, leurs investigations biologiques ne sont pas accessibles. Nous rapportons la première expérience de diagnostic du lupus anticoagulant à Ouagadougou, au Burkina Faso.
Il s’est agi d’une étude transversale en milieu hospitalier qui a inclus des femmes ayant présenté une prééclampsie ou une éclampsie sévère. Les échantillons ont été prélevés et traités dans le respect des exigences pré-analytiques. Le temps de venin de vipère de Russel dilué (TVVRd) a été utilisé pour le diagnostic de l’anticoagulant lupique suivant un algorithme en trois étapes (dépistage, test de mélange et confirmation). Le test était positif si le ratio normalisé (TVVRd dépistage / TVVRd confirmation) > 1,2.
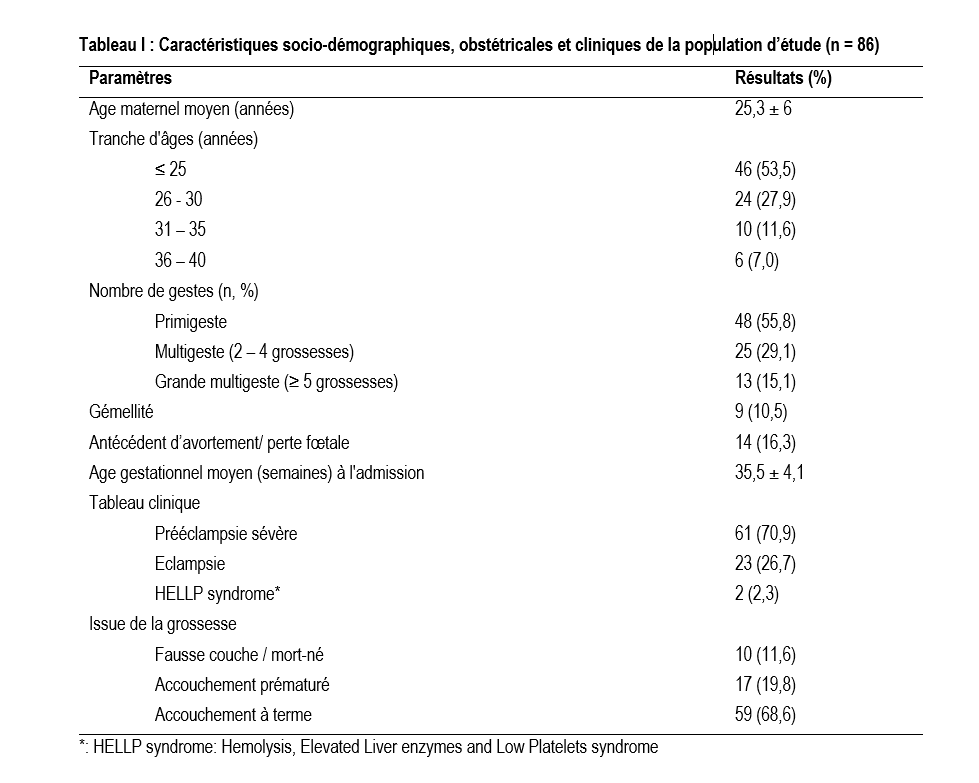
Au total 86 patientes d’âge moyen de 25,3 ± 6 ans ont été incluses. La majorité, soit 70,9% (61/86) avait une prééclampsie sévère. Les primigestes représentaient 55,8% (48/86) et les primipares 58,2% (50/86). Une prématurité et une mort fœtale ont été notées dans 31,4% des cas. La prévalence de l'anticoagulant lupique était de 22,1%. Le diagnostic de syndrome des anti-phospholipides obstétrical pouvait être évoqué dans 4,6 % des cas.
Conclusion
Le diagnostic de l'anticoagulant lupique est aisé. Toutefois, des validations de méthodes et de contrôles ainsi que la mise en place d’autres techniques telle que la recherche des anticorps anti-cardiolipine et anti-β-glycoprotéine I sont nécessaires pour améliorer l'exploration des syndromes des anticorps anti-phospholipides.
Antiphospholipid syndrome is associated with complications and adverse pregnancy outcomes in sub-Saharan Africa. However, due to the poor development of laboratories, their biological diagnosis is not always available. We report in this study the first experience of biological diagnosis of anticoagulant lupus in Ouagadougou, Burkina Faso.
We conducted a hospital-based cross-sectional study that included women with severe preeclampsia or eclampsia. Samples were collected and processed in compliance with pre-analytical requirements. Diluted Russell's viper venom time (dRVVT) was used to diagnose anticoagulant lupus using a three-step algorithm (screen, mix and confirmation tests). The test was positive if the normalized ratio (screen dRVVT/confirmation dVVRT) > 1.2.
A total of 86 patients with a mean age of 25.3 ± 6 years were included. The majority, 70.9% (61/86) had severe preeclampsia. Primigravida represented 55.8% (48/86) and primipara 58.2% (50/86). Prematurity or fetal death were noted in 31.4% of cases. The prevalence of anticoagulant lupus was 22.1%. The diagnosis of obstetric anti-phospholipid syndrome could be evoked in 4.6% of cases.
Conclusion :
The diagnosis of anticoagulant lupus is straightforward. However, validation of methods and controls and the introduction of other techniques such as detection of anti-cardiolipin and anti-β-glycoprotein I antibodies, are needed to improve the investigation of anti-phospholipid antibody syndromes in our context.
Salam SAWADOGO, Laboratoire d’hématologie, Université Joseph KI-ZERBO, 01 BP 865 Ouagadougou 01 – Tél : (00226) 70032776 – Email : Cette adresse e-mail est protégée contre les robots spammeurs. Vous devez activer le JavaScript pour la visualiser. ; Cette adresse e-mail est protégée contre les robots spammeurs. Vous devez activer le JavaScript pour la visualiser.
Introduction
Le syndrome des anticorps anti-phospholipides (SAPL) est une entité pathologique clinico-biologique causée par des auto-anticorps hétérogènes dirigés contre les phospholipides (cardiolipine, phosphatidylsérine, phosphatidyléthanolamine) ainsi que les protéines plasmatiques se liant à elles (β2-glyco-protéine I, prothrombine). Les plus courants sont le lupus anticoagulant (LA) ou anticoagulant lupique, les anticorps anti-cardiolipines (aCL) et les anticorps anti-β2-glycoprotéine I (anti-ß2-GPI) [1–3]. Le diagnostic positif repose sur l'association d'au moins une manifestation clinique (thromboses vasculaires, éclampsies, fausses couches à répétition, prématurité, etc.) et la présence persistante sur deux prélèvements à 12 semaines d’intervalle au moins, d’un LA et/ou d’un aCL IgG et/ou IgM et/ou d’un anti- aβ2GP1 IgG et/ou IgM [4,5].
En Afrique sub-saharienne, la prééclampsie et les problèmes d'hypertension artérielle associée à la grossesse (avec des prévalences atteignant 16,7%), constituent la seconde cause de décès maternels (22,1%) après les hémorragies obstétricales [6]. Plusieurs facteurs ont été identifiés comme étant associés à la prééclampsie, dont les aPL [7,8], avec un risque relatif variant entre 6,12 et 9,72 selon les études [9]. Le LA est présenté comme un des principaux facteurs prédictifs d'issues défavorables pendant la grossesse et constitue une anomalie sérologique très fréquente (environ 50% des cas) [10].
Au Burkina Faso, l'incidence hospitalière des éclampsies est d'au moins un cas par jour avec un taux de létalité de 9,6 % [11]. Les investigations de ces complications obstétricales sont le plus souvent limitées à la recherche de causes obstétricales ou médicales générales. Si dans les pays développés, la recherche des anticorps aPL est une pratique courante, cela n’est pas le cas dans notre contexte, faute de plateau technique approprié [12]. Cet article présente la première expérience de diagnostic du lupus anticoagulant dans un laboratoire de biologie médicale à Ouagadougou, au Burkina Faso.
Patients et méthodes
Cadre et population de l'étude
Il s’est agi une étude transversale conduite entre mai et août 2019 au laboratoire de biologie médicale du Centre hospitalier universitaire pédiatrique Charles de Gaulle de Ouagadougou. Ce laboratoire fait office de laboratoire de référence en hémostase au Burkina Faso, notamment pour le diagnostic de l'hémophilie et d’autres maladies hémorragiques. En effet, outre les tests globaux de la coagulation, c'est le seul laboratoire au Burkina Faso à même de réaliser le dosage de certains facteurs spécifiques de la coagulation. En revanche, pour les maladies thrombotiques, seul le dosage des D-dimères sont couramment réalisés.
L'étude a inclus des échantillons de femmes admises pour prééclampsie sévère ou éclampsie conformément à la définition de l’Organisation mondiale de la santé (OMS). La prééclampsie sévère a été définie par une pression artérielle systolique ≥ 160 mm Hg ou une pression artérielle diastolique ≥ 110 mm Hg, mesurée à deux reprises chez une femme enceinte de plus de 20 semaines d'aménorrhées (SA), associée à un signe de gravité tel qu'une oligurie, une protéinurie à trois croix (3+) à la bandelette urinaire, des céphalées, des troubles visuels, ou un HELLP syndrome. L'éclampsie est définie par une prééclampsie associée à des crises convulsives généralisées d'apparition récente [13–15]. Le SAPL obstétrical a été défini par un test positif pour le LA associé à au moins trois avortements spontanés consécutifs avant 10 SA ou une mort fœtale inexpliquée à partir de 10 SA ou un accouchement prématuré avant 34 SA dû à une éclampsie ou prééclampsie sévère [16].
Les femmes ayant des antécédents de pathologies médicales ou infectieuses chroniques, de traitement anticoagulant, de déficit congénital connu en facteurs de coagulation ont été exclues. Les caractéristiques socio-démographiques, les antécédents obstétricaux et les données obstétricales et périnatales ont été recueillis à partir des dossiers cliniques. Un prélèvement sanguin a été fait chez chaque patiente pour la recherche du LA.
Prélèvements sanguins et gestion des échantillons
Les tests de coagulation sont fortement influencés par les aspects pré-analytiques et analytiques. Aussi, des mesures ont été prises lors des prélèvements et traitements des échantillons pour limiter leurs effets. Chez chaque patiente, un volume d’environ 4,5 mL de sang veineux a été prélevé après l'accouchement dans un tube plastique citraté contenant 0,5 mL du citrate trisodique à 3,2 % (0,109 M). Les tubes ont été homogénéisés par retournements successifs. Les échantillons ont été transportés à température ambiante dans les 4 heures suivant le prélèvement au laboratoire où ils ont été traités. Une première centrifugation à 2270 g pendant 15 minutes à température ambiante a permis de recueillir des plasmas riches en plaquettes (PRP). Les PRP ont été centrifugés une seconde fois à 3000 g pendant 10 minutes en vue d’obtenir des plasmas pauvres en plaquettes (PPP) qui ont été aliquotés dans des cryotubes en plastique, congelé et conservé à - 80°C jusqu’à la réalisation des analyses.
Description de la technique et méthodes de diagnostic biologique du lupus anticoagulant
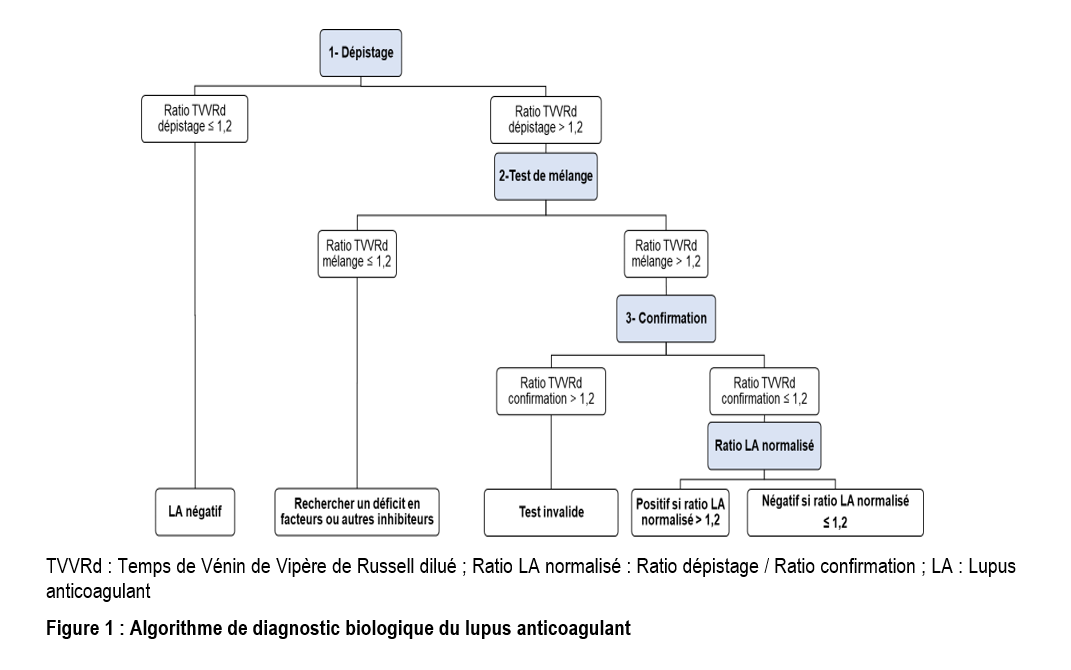
La technique utilisée pour la recherche des anticorps aPL de type LA reposait sur le temps de venin de vipère de Russell dilué (TVVRd), réalisé sur semi-automate SIEMENS® CA-600 avec des réactifs SYSMEX®. C'est un test fonctionnel basé sur la capacité du LA à prolonger un temps de coagulation dépendant des phospholipides [17,18]. Un algorithme en trois étapes a été utilisé : (i) une phase de dépistage avec le réactif de dépistage LA1, (ii) un test de mélange 1:1 de plasma du patient et de pool de PPP normal et (iii) une phase de confirmation avec le réactif de confirmation LA2.
Le réactif LA1 est pauvre en phospholipides et contient un activateur de la coagulation. En l'absence de LA ou d'autres anomalies (déficit en facteur, inhibiteurs non-lupiques, etc.), le TVVRd dépistage est normal. Si un LA est présent dans le plasma du patient, il entre en compétition avec l'activateur du réactif pour la liaison sur les phospholipides présents, entrainant alors un allongement du TVVRd dépistage. Le résultat final est exprimé en ratio de dépistage (TVVRd dépistage /TVVRd moyen du LA1) avec un seuil de 1,2 (positif si > 1,2 ; négatif si ≤ 1,2). Le test de mélange est réalisé en cas de résultat positif. Le pool de PPP normal n’apportant pas de phospholipides, si le temps de coagulation se normalise (ratio TVVRd mélange/TVVRd plasma normal ≤ 1,2), alors on conclut que l’allongement du TVVRd est lié à un déficit de facteurs ou à un inhibiteur non-LA. En revanche, en présence d'un LA, le ratio mélange n'est pas corrigé (ratio TVVRd mélange/TVVRd plasma normal > 1,2). Dans ce cas, le test de confirmation est alors réalisé à l'aide du réactif LA2 qui contient un excès de phospholipides. La quantité de phospholipides est normalement suffisante pour neutraliser l'effet d'un éventuel LA, ce qui permet de normaliser ainsi le TVVRd confirmation. Un TVVRd confirmation restant allongé avec un ratio confirmation (TVVRd confirmation/TVVRd moyen LA2) supérieur à 1,2 est un résultat invalide imposant la reprise du test. Un ratio LA normalisé (Ratio dépistage / Ratio confirmation) > 1,2 confirme la présence d'un LA.
Les réactifs LA1 et LA2 ont été préparés en utilisant respectivement 2 mL et 1 mL d'eau distillée et conservés pendant 48 heures entre 2 et 8 °C, conformément aux instructions du fabricant.
La figure 1 décrit l'algorithme de diagnostic biologique du lupus anticoagulant.
Analyses statistiques
Les données ont été saisies dans le logiciel Epi-info et exportées dans STATA 15 pour les analyses statistiques. Les variables quantitatives et qualitatives ont été décrites en utilisant respectivement les moyennes ± 2SD (écart-type) et les proportions. Le test du chi-carré (ou le test exact de Fisher si indiqué) a été utilisé pour comparer les proportions et le test t de Student pour les moyennes entre les cas positifs et négatifs. La normalité de la distribution de l’âge maternel, l’âge gestationnel et les ratios dépistage et LA normalisé a été vérifiée par le test de Kolmogorov-Smirnov. Les différences ont été considérées statistiquement significatives pour un p < 0,05.
Considérations administratives et éthiques
L’étude a été conduite avec l’autorisation administrative des responsables des différents hôpitaux concernés. Toutes les patientes ont donné leur consentement pour participer à l’étude. Les résultats des tests réalisés ont été communiqués aux médecins traitants pour considération pour la suite de la prise en charge des patientes.
Résultats
Au total, 86 patientes ont été incluses. Elles avaient un âge moyen de 25,3 ± 6 ans. La tranche d'âge de moins de 25 ans était la plus représentée avec 53,5% (46/86). La majorité (61/86) avait une prééclampsie sévère, les primigestes représentaient 55,8% (48/86) et les primipares 58,2% (50/86). Le tableau I donne les caractéristiques socio-démographiques et obstétricales des femmes incluses dans l'étude.
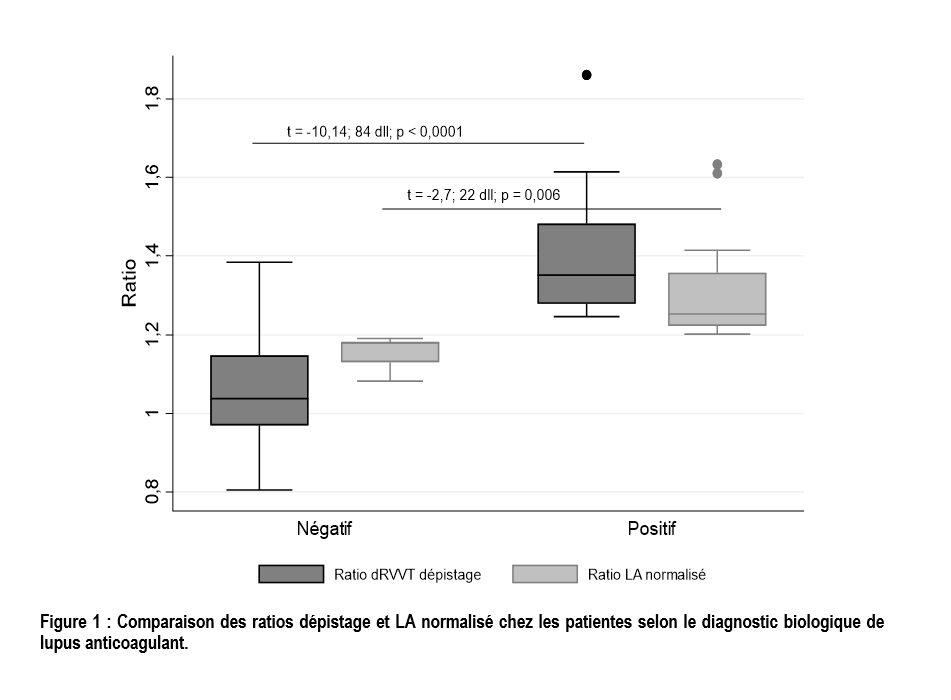
Le TVVRd dépistage était allongé avec un ratio TVVRd dépistage > 1,2 dans 24 cas (27,9%). Au total, 19 patientes (22,1%) avaient un ratio LA normalisé > 1,2. Les ratios TVVRd dépistage et LA normalisé étaient significativement plus élevés chez les parturientes avec un diagnostic biologique de LA (figure 1).
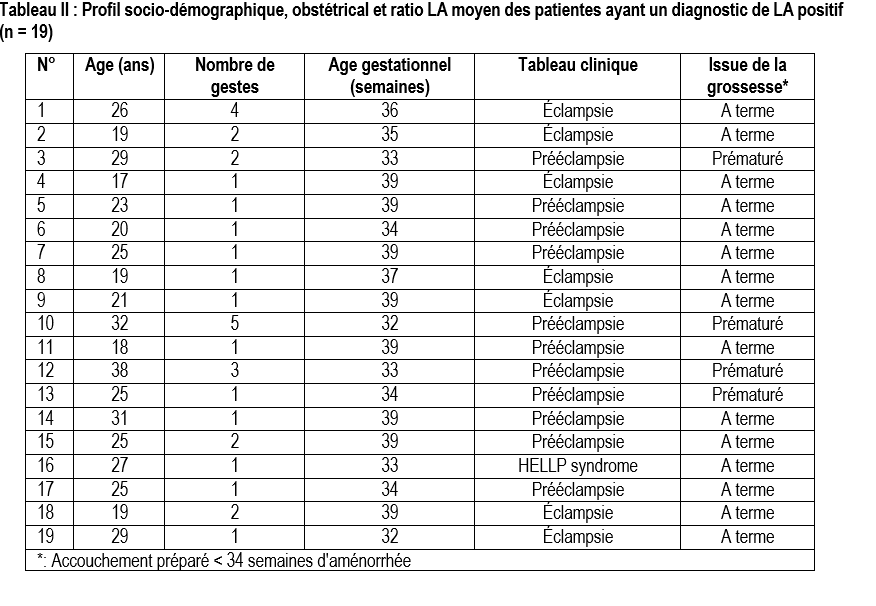
L'issue de la grossesse a été favorable chez toutes les 19 patientes ayant un LA avec cependant, quatre cas d'accouchement prématuré, correspondant à une fréquence de 4,6% de SAPL obstétrical. Le tableau II donne les caractéristiques des patientes chez qui le diagnostic de LA était positif. Aucun facteur maternel ou obstétrical n'était associé à la positivité du LA (tableau III).
Discussion
La prééclampsie et les problèmes d'hypertension artérielle associée à la grossesse constituent un problème de santé publique en Afrique sub-saharienne. Ils sont fréquemment associés aux aPL [9]. Ce travail avait pour but de rapporter notre expérience de diagnostic biologique des aPL de type de LA chez des gestantes et parturientes admises pour prééclampsie sévère ou éclampsie. Le diagnostic de LA était positif dans 22,1%.
Notre échantillon d'étude était constitué de 86 patientes dont 70,9% présentaient une prééclampsie sévère et 2,3% un HELLP syndrome. L'âge moyen était de 25 ans et la majorité était des primigestes (55,8%). Ce profil est concordant avec les résultats d'études antérieures. En effet, Ouattara et al.[19] en 2015 ainsi que Kanyala et al. en 2019 [11] à Ouagadougou trouvaient des âges moyens de 27,5 et 26 ans respectivement. Au Mali, Kampo et al. notaient 85,3% de patientes de moins de 26 ans [20]. Le jeune âge est décrit comme étant un facteur de risque associé à la prééclampsie avec un risque relatif de 1,38 à 1,68 [9]. La nulliparité a également été décrite comme un facteur de risque de prééclampsie [9]. En effet, la prééclampsie survient dans 70 à 75% des cas lors d’une première grossesse [21]. Cette proportion diminue avec les grossesses suivantes, du fait d'une adaptation immunologique de l'organisme de la mère aux antigènes du géniteurs exprimés par le trophoblaste, lors de la placentation [21]. Dans notre étude, le jeune âge des patientes et le fait qu'elles soient majoritairement primigestes (55,8%) pourraient être liés, eu égard à la précocité des mariages chez les filles dans notre contexte.
La prévalence de 22,1% d'anticorps aPL de type LA trouvée dans notre étude était légèrement différente de celles rapportées par certains auteurs. Au Nigeria, des fréquences de 15,4% et 10% avaient été rapportées chez les femmes atteintes de prééclampsie [22,23]. En France, une prévalence de 7,7% [24] avait été notée. Les caractéristiques des patientes (âge, race, antécédents obstétricaux et cliniques et spécificités génétiques), mais surtout les aspects analytiques au laboratoire (natures et performances des tests et les algorithmes utilisés) pourraient expliquer ces différences. En effet, le diagnostic biologique du LA, outre les problèmes pré-analytiques, connaît trois défis majeurs liés aux phases analytiques et post-analytiques à savoir, la méthode d'analyse, les contrôles qualité et les critères d'interprétation des résultats.
L'International Society on Thrombosis and Haemostasis (ISTH), a établi les critères suivants pour le diagnostic du LA: (i) un temps de coagulation prolongé lors d'un test de dépistage phospholipides-dépendant, (ii) un test de mélange indiquant la présence d'un inhibiteur par une absence ou une insuffisance de correction du temps de coagulation, et (iii) un test de confirmation démontrant la dépendance de l'inhibiteur à l'égard des phospholipides [25]. La procédure intégrée en trois étapes est préconisée pour le diagnostic du LA: 1) au moins deux tests sensibles aux LA dans la phase de dépistage, 2) un test de mélange 1:1 de plasma du patient et de plasma normal pour confirmer la présence d'inhibiteur, et 3) un test de confirmation par la neutralisation de l'anticoagulant par des phospholipides [18,25].
Le principe qui sous-tend les analyses de diagnostic du LA est simple. En présence d'aPL de type LA, il y a une compétition entre l'anticorps et l'activateur de la coagulation contenu dans le réactif pour se fixer aux phospholipides, entraînant l’allongement des temps de coagulation in vitro. L'apport de phospholipides au mélange permet la correction de ce phénomène, confirmant la présence de l'aPL [26].
Pour la mise en place du diagnostic biologique du LA dans notre laboratoire, nous avons opté pour le test du TVVRd comme test de coagulation dépendant des phospholipides. Le TVVRd constituent avec le temps de céphaline avec activateur (TCA), le temps de prothrombine dilué (TPd) les trois principaux tests décrits comme étant sensibles au LA [25]. Comme l'illustre notre algorithme (figure 1), la méthode diagnostique mise en place tient compte de l'algorithme intégré en trois étapes (dépistage, mélange et confirmation) de l'ISTH décrit ci-dessus. Toutefois, elle pêche par le recours à un seul test de dépistage. En effet, en raison de l'hétérogénéité des aPL, aucun test unique ne permet d'identifier tous les cas, pouvant induire des résultats erronés. La combinaison de deux tests sensibles au LA et de principes différents permet d'atténuer les risques d'erreurs diagnostiques [27].
Outre le choix des tests et l'algorithme diagnostic du LA, l'interprétation des résultats constitue également une étape critique pour la fiabilité du diagnostic. En effet, il n’est pas si facile de déterminer à partir de quel moment il faut considérer un temps de coagulation comme "prolongé" et donc quand un échantillon doit être évalué comme étant revenu à la "normale" ou comme ayant subi une "correction" [26]. Cette difficulté réside dans le fait qu'il n'y a pas de critères d'interprétation de référence unanimement acceptés [25,26]. Dans notre algorithme, nous avons utilisé le ratio normalisé (ratio dépistage/ratio confirmation) comme critère d'interprétation des tests (Figure 1). D'autres critères d'interprétation existent comme le pourcentage de correction du temps de coagulation [100 x (dépistage – confirmation)/dépistage], le pourcentage de correction du ratio [100 x (ratio dépistage – ratio confirmation)/ratio dépistage] [26] ou l'Indice de Rosner [100 x (temps du mélange 1:1 plasma normal)/plasma du patient] [28]. Toutefois, la tendance générale au niveau des laboratoires est d'interpréter les résultats des tests sur la base du ratio normalisé [25,29].
Sur la base de nos critères d'interprétation, environ 27,9% des patientes avait un TVVRd allongé au dépistage et le diagnostic de LA positif a été confirmé chez 22,1% (19 patientes) d'entre elles. Aucun facteur maternel ou obstétrical n'a été trouvé associé à la positivité du LA. Gebhart et al. ont noté une association entre l'âge maternel, l'indice de Rosner et l'issue de la grossesse [28]. D'autres études ont noté que le jeune âge de la patiente [30], les antécédents de pertes de fœtus (avortement ou mort fœtale) (OR = 8,74) [31] et la triple positivité aux aPL de type LA, aCL et anti-ß2-GPI (OR = 21,3) [30] étaient significativement associés aux mauvaises issues de grossesses chez les patientes possédant des aPL. La taille limitée de notre échantillon ne permettait probablement pas de mettre en évidence des associations significatives. Toutefois, nous avons noté dans quatre cas des accouchements prématurés précoces (< 34 semaines), répondant ainsi au diagnostic de SAPL obstétrical.
Notre étude comportait des limites. Premièrement, nous n'avons pas défini de valeurs de références locales comme cela est préconisé. Les valeurs de références sont définies sur la base de la moyenne des temps de coagulation obtenus chez au moins 20 - 30 sujets sains normaux. De telles valeurs de référence sont plus appropriées pour les contrôles qualité de validation des résultats des tests d'hémostase, car elles reflètent les caractéristiques biologiques propres aux populations locales. Deuxièmement, nous n'avons pas utilisé les deux réactifs sensibles aux LA comme recommandé par l'ISTH. Donc l'algorithme que nous proposons ne permet probablement pas de dépister tous les cas d'aPL. Enfin, d’un point de vue biologique, le diagnostic d'un syndrome des aPL requiert une positivité des tests sur deux mesures consécutives à au moins 12 semaines d’intervalle [25]. Dans notre travail, nous n'avons pas pu faire cette confirmation.
Conclusion
Cette étude est la première expérience d'implémentation d'une méthode de diagnostic des aPL dans un laboratoire local au Burkina Faso. Jusque-là, en dehors des D-dimères, aucune autre analyse de diagnostic biologique des maladies thrombotiques n'était disponible dans le pays. Elle constitue de ce fait une acquisition de nouvelles compétences qui contribueront à l'amélioration de la prise en charge de ces pathologies dans notre pays. Toutefois, il urge de travailler à l'amélioration de l'algorithme par l'association d'un deuxième test sensible aux LA dans un premier temps, notamment le TCA qui est le test le plus accessible dans notre contexte. Dans un deuxième temps, il faudrait travailler à développer les tests ELISA pour le dépistage des autres aPL, notamment les aCL et anti- anti-ß2-GPI. Enfin, des études futures de validation en tenant compte de la nécessité de définir des normes locales sont nécessaires.
Conflit d’intérêt
Aucun
Financement
Ce travail est issu d’un mémoire d’études de spécialisation en biologie clinique. Il a obtenu le soutien en réactif de SYSMEX-PARTEC Burkina Faso.
Contribution des auteurs
MOA et KE ont conçu l’étude et élaboré le protocole. MOA a collecté les données. MOA, SS, NK, NMM, SA ont analysé les données et interprété les résultats. SS et MOA ont proposé le draft. Tous les auteurs ont relu le manuscrit et donné leur approbation pour sa publication.
Remerciements
Nos remerciements à SYSMEX-PARTEC Burkina Faso pour le soutien en réactif, ainsi qu’aux responsables et aux personnels des trois services de maternité pour leur collaboration.
- Visseaux B, Masliah-Planchon J, Fischer AM, Darnige L. Antiphospholipid syndrome diagnosis: an update. Annales de biologie clinique 2011;69(4):411‑8.
- Vashisht A, Regan L. Antiphospholipid syndrome in pregnancy – an update. J R Coll Physicians Edinb. 2005;35:337‑9.
- Cervera R. Update on the Diagnosis, Treatment, and Prognosis of the Catastrophic Antiphospholipid Syndrome. Curr Rheumatol Rep. 2010;12(1):70‑6.
- Joste V, Dragon-Durey MA, Darnige L. Diagnostic biologique du syndrome des antiphospholipides : des critères à la pratique. La Revue de Médecine Interne. 2018;39(1):34‑41.
- Miyakis S, Lockshin MD, Atsumi T, Branch DW, Brey RL, Cervera R, et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). Journal of Thrombosis and Haemostasis. 2006;4(2):295‑306.
- Musarandega R, Nyakura M, Machekano R, Pattinson R, Munjanja SP. Causes of maternal mortality in Sub-Saharan Africa: A systematic review of studies published from 2015 to 2020. J Glob Health. 2021;11:04048.
- Branch DW, Gibson M, Silver RM. Recurrent Miscarriage. N Engl J Med. 2010;363(18):1740‑7.
- Mankee A, Petri M, Magder LS. Lupus anticoagulant, disease activity and low complement in the first trimester are predictive of pregnancy loss. Lupus Science & Medicine. 2015;2(e000095):5.
- Duckitt K, Harrington D. Risk factors for pre-eclampsia at antenatal booking: systematic review of controlled studies. BMJ. 2005;330(7491):565.
- Alijotas-Reig J, Esteve-Valverde E, Ferrer-Oliveras R, Sáez-Comet L, Lefkou E, Mekinian A, et al. The European Registry on Obstetric Antiphospholipid Syndrome (EUROAPS): A survey of 1000 consecutive cases. Autoimmunity Reviews. 2019;18(4):406‑14.
- Kanyala E, Ouédraogo B, Kiemtoré S, Kaboré C, Bonané/Thiéba B. Décès maternels par prééclampsie dans le département de gynécologie et d’obstétrique du CHU Yalgado Ouédraogo. Med Afr Noire. 2019;6601:54‑62.
- N’dhatz EC, Packo SD le veut SC, Danho NC, Karama I, Boidy B, Diabaté M, et al. Le Syndrome des Anticorps Anti Phospholipides: Une Etiologie des Fausses Couches Laquelle on Ne Pense pas Souvent en Afrique Noire. ESJ. 31 oct 2019;15(30):172‑82.
- Bouter AR, Duvekot JJ. Evaluation of the clinical impact of the revised ISSHP and ACOG definitions on preeclampsia. Pregnancy Hypertension 2020;19:206‑11.
- Organisation Mondiale de la Santé. Recommandations pour la pratique clinique des soins obstétricaux et néonataux d’urgence en Afrique: guide du prestataire. Brazaville: OMS/AFRO; 2018. Report No.: Licence : CC BY-NC-SA 3.0 IGO.
- American College of Obstetricians and Gynecologists. Gestational hypertension and preeclampsia. ACOG Practice Bulletin No. 202. Obstet Gynecol. 2019;133:e1-25.
- Marchetti T, Cohen M, de Moerloose P. Obstetrical Antiphospholipid Syndrome: From the Pathogenesis to the Clinical and Therapeutic Implications. Clinical and Developmental Immunology. 2013;2013(Article ID 159124):1‑9.
- An GD, Lim HH, Han JY. Laboratory Diagnosis of Antiphospholipid Syndrome. Clin Exp Thromb Hemost. 2017;3(1):2‑7.
- Depreter B, Devreese KMJ. Dilute Russell’s viper venom time reagents in lupus anticoagulant testing: a well-considered choice. Clinical Chemistry and Laboratory Medicine (CCLM). 2017;55(1):91‑101.
- Ouattara A, Ouédraogo CMR, Ouédraogo A, Kain DP, Zamané H, Kiemtoré S, et al. L’éclampsie au CHU-Yalgado de Ouagadougou (Burkina Faso) du 1er avril 2013 au 31 mars 2014. Bull Soc Pathol Exot. 2015;108(5):316‑23.
- Kampo MI, Sogoba S, Kassogué D, Konaté I, Ongoiba O, Sissoko D, et al. Pronostic maternel et périnatal de l´éclampsie à l´hôpital de Tombouctou au Mali. Pan Afr Med J 2020;36(175). 10.11604/pamj.2020.36.175.17976
- Deis S, Haddad B. Principales complications de la grossesse. La revue du praticien. 2006;(56):1033‑8.
- Nwogoh B, Awodu OA, Aziken ME, Nwannadi AI. Antiphospholipid Antibodies in Women with Preeclampsia Seen at the University of Benin Teaching Hospital, Benin City, Nigeria. Int J Health Sci Res. 2014;4(2):140‑8.
- Awodu O, Shokunbi W, Ejele O, Ejele O, Shokunbi W. Lupus anticoagulant in Nigerian women with preeclampsia. West African Journal of Medicine. 2004;22(3):240‑2.
- Marchetti T, de Moerloose P, Gris JC. Antiphospholipid antibodies and the risk of severe and non-severe pre-eclampsia: the NOHA case-control study. J Thromb Haemost. 2016;14(4):675‑84.
- Devreese KMJ, Groot PG, Laat B, Erkan D, Favaloro EJ, Mackie I, et al. Guidance from the Scientific and Standardization Committee for lupus anticoagulant/antiphospholipid antibodies of the International Society on Thrombosis and Haemostasis: Update of the guidelines for lupus anticoagulant detection and interpretation. J Thromb Haemost. 2020;18(11):2828‑39.
- Sysmex Educational Enhancement & Development. Lupus Anticoagulant testing in the coagulation laboratory. SEED-Africa Newsletter. 2012;2:1‑7.
- Swadzba J, Iwaniec T, Pulka M, De Laat B, De Groot PG, Musial J. Lupus anticoagulant: performance of the tests as recommended by the latest ISTH guidelines. Journal of Thrombosis and Haemostasis. 2011;9(9):1776‑83.
- Gebhart J, Posch F, Koder S, Quehenberger P, Perkmann T, Kuessel L, et al. High risk of adverse pregnancy outcomes in women with a persistent lupus anticoagulant. Blood Advances. 2019;3(5):769‑76.
- Tripodi A. Diagnostic Challenges on the Laboratory Detection of Lupus Anticoagulant. Biomedicines. 2021;9(7):844.
- Lazzaroni MG, Fredi M, Andreoli L, Chighizola CB, Del Ross T, Gerosa M, et al. Triple Antiphospholipid (aPL) Antibodies Positivity Is Associated With Pregnancy Complications in aPL Carriers: A Multicenter Study on 62 Pregnancies. Front Immunol. 2019;10:1948.
- Deguchi M, Yamada H, Sugiura-Ogasawara M, Morikawa M, Fujita D, Miki A, et al. Factors associated with adverse pregnancy outcomes in women with antiphospholipid syndrome: A multicenter study. Journal of Reproductive Immunology. 2017;122:21‑7.